
| A. | 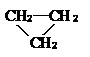 和CH3CH=CH2 和CH3CH=CH2 | B. | 淀粉和纤维素 | ||
| C. | CH3CH2CH2CH3和CH3CH2CH3 | D. | 乙烷和乙酸 |
科目:高中化学 来源: 题型:选择题
| A. | 8-m-n | B. | a-8+m-n | C. | a+18-m-n | D. | a+24-m-n |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯气与紫色石蕊溶液--先变红后褪色 | |
| B. | 过量的Cl2与KI淀粉溶液--变蓝 | |
| C. | SO2与紫色石蕊溶液--变红 | |
| D. | 硫化氢与湿润的醋酸铅试纸--变黑 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
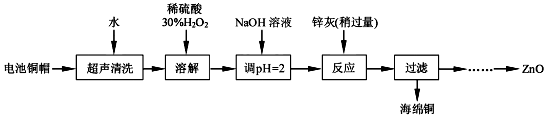
| Fe3+ | Fe2+ | Zn2+ | |
| 开始沉淀的pH | 1.1 | 5.8 | 5.9 |
| 完全沉淀的pH | 3.2 | 8.8 | 8.9 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 氢氧化物 | Fe(OH)3 | Fe(OH)2 |
| 开始沉淀的pH | 1.5 | 6.5 |
| 沉淀完全的pH | 3.7 | 9.7 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 实验 编号 | 起始时各物质的物质的量/mol | 达到平衡时体系的变化 | 平衡时NH3的体积分数 | ||
| N2 | H2 | NH3 | |||
| ① | 1 | 3 | 0 | 放出热量:23.15 kJ | W1 |
| ② | 0.9 | 2.7 | 0.2 | 放出热量:Q kJ | W2 |
| A. | W1>W2,Q<23.15 | B. | W1=W2,Q=23.15 | C. | W1<W2,Q>23.15 | D. | W1=W2,Q<23.15 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
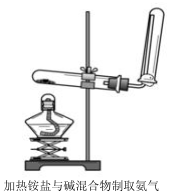 实验室一般采用如下装置制取氨气,按要求回答下列问题:
实验室一般采用如下装置制取氨气,按要求回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{ρV}{MV+2240}$mol/L | B. | $\frac{1000ρV}{MV+2240}$mol/L | ||
| C. | $\frac{MV}{22.4V+0.1ρ}$mol/L | D. | $\frac{V}{2.24}$mol/L |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com