
氧化还原反应与四种基本类型反应的关系如图所示,则下列化学反应属于区域3的是
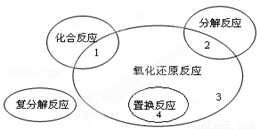
A.Zn+H2SO4=ZnSO4+H2↑
B.3CO+Fe2O3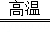 2Fe+3CO2
2Fe+3CO2
C.CaO+H2O=Ca(OH)2
D.CaCO3 CaO+CO2
CaO+CO2
 活力课时同步练习册系列答案
活力课时同步练习册系列答案 学业测评一课一测系列答案
学业测评一课一测系列答案科目:高中化学 来源:2015-2016学年四川省高一上期中测试化学试卷(解析版) 题型:选择题
在强酸性溶液中,下列离子组能大量共存且溶液为无色透明的是
A.Na+、K+、OH-、CI- B.Na+、Cu2+、SO42-、NO3-
C.Mg2+、Na+、SO42-、Cl- D.Ba2+、K+、HCO3-、NO3-
查看答案和解析>>
科目:高中化学 来源:2015-2016学年宁夏银川市高一上学期期中测试化学试卷(解析版) 题型:选择题
某同学想要从碘的饱和水溶液中萃取碘,关于该实验的说法中不正确的是
A、使用分液漏斗前应先检查其是否漏液
B、可以选用苯、汽油、酒精和四氯化碳为萃取剂
C、若用四氯化碳为萃取剂,将两种液体混合,充分振荡,静置,分层后,下层液体呈紫红色
D、分层后,打开分液漏斗活塞,使全部下层液体沿承接液体的烧杯内壁流出,然后上层液体从漏斗上口倒出
查看答案和解析>>
科目:高中化学 来源:2016届广东省佛山市顺德六校高三上学期期中理综化学试卷(解析版) 题型:填空题
(1)已知H-H 键能为436 kJ·mol-1,H-N键键能为391 kJ·mol-1,根据化学方程式: N2(g)+3 H2(g) 2NH3(g) ΔH=-92.4kJ·mol-1。则N≡N键的键能是_________________
2NH3(g) ΔH=-92.4kJ·mol-1。则N≡N键的键能是_________________
(2)事实证明,能设计成原电池的反应通常是放热反应,下列化学反应在理论上可以设计成原电池的是__________________。
A.C(s) + H2O(g) = CO(g) + H2(g) △H > 0
B.2H2(g)+O2(g)=2H2O(1) △H < 0
C.NaOH(aq) + HC1(aq) = NaC1(aq) + H2O(1) △H < 0
(3)以KOH溶液为电解质溶液,依据所选反应设计一个原电池,其正极的电极反应式___________。

(4)电解原理在化学工业中有着广泛的应用。现将你设计的原电池通过导线与图中电解池相连,其中为 a电解液,X和Y均为惰性电极,则
①若a为CuSO4溶液,则电解时的化学反应方程式为 。
②若电解含有0.04molCuSO4和0.04molNaCl的混合溶液400ml,当阳极产生的气体672mL(标准状况下)时,溶液的pH=_______(假设电解后溶液体积不变)。
③若用此电解装置模拟工业精炼铜,则应将a改为 溶液,并将 极换成粗铜(填“X”或“Y”)
查看答案和解析>>
科目:高中化学 来源:2015-2016学年广西省高一上学期期中测试化学试卷(解析版) 题型:填空题
完成下列各题:
(1)在18.6g Fe和Zn合金中加入200mL某浓度的稀硫酸恰好完全反应,生成0.3mol H2.则原合金中有__________mol Fe,稀硫酸的物质的量浓度为__________ mol/L.
(2)已知19.2gCu与过量的200ml 5mol/L稀硝酸充分反应,反应方程式如下,请计算(忽略反应前后溶液体积的变化).3Cu+8HNO3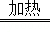 3Cu(NO3)2+2NO↑+4H2O
3Cu(NO3)2+2NO↑+4H2O
①转移电子的个数为__________(用NA表示阿伏加德罗常数);标准状况下,产生NO气体的体积为__________.
②反应后,H+的物质的量浓度为__________,NO3﹣的物质的量浓度为__________.
查看答案和解析>>
科目:高中化学 来源:2015-2016学年河南省高二上学期第二次月考化学试卷(解析版) 题型:选择题
降低温度时,下列数据不一定减小的是
A.化学反应速率v
B.溶度积常数Ksp
C.水解平衡常数Kh
D.水的离子积常数Kw
查看答案和解析>>
科目:高中化学 来源:2016届北京市高三上学期期中测试化学试卷(解析版) 题型:选择题
为实现下列实验目的,所用试剂合理的是
选项 | 实验目的 | 试剂 |
A | 验证Br2的氧化性强于I2 | 溴水、KI溶液、淀粉溶液 |
B | 除去Fe2O3中的Al2O3 | 稀盐酸 |
C | 检验Fe3O4溶于盐酸后的金属阳离子 | NaOH溶液 |
D | 制备Fe(OH)3胶体 | 饱和FeCl3溶液、NaOH溶液 |
查看答案和解析>>
科目:高中化学 来源:2016届四川省广元市高三上学期第三次段考理综化学试卷(解析版) 题型:选择题
根据表中的信息判断下列说法正确的是
物质 | 金刚石 | 石墨 |
外观 | 无色,透明固体 | 灰黑,不透明固体 |
熔点 | ? | ? |
燃烧热/(kJ·mol-1) | 395.4 | 393.5 |
A.表示石墨燃烧热的热化学方程式为C (石墨,s)+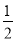 O2(g)===CO(g) ΔH=-393.5 kJ·mol-1
O2(g)===CO(g) ΔH=-393.5 kJ·mol-1
B.由表中信息知C(石墨,s)===C(金刚石,s) ΔH=+1.9 kJ·mol-1
C.由表中信息可得如图所示的图像
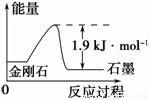
D.由表中信息可推知相同条件下金刚石的熔点高于石墨的
查看答案和解析>>
科目:高中化学 来源:2015-2016学年上海市高二上学期期中测试化学试卷(解析版) 题型:选择题
人体正常的血红蛋白应含Fe2+。若误食外表与食盐相近的亚硝酸盐,则导致血红蛋白中的Fe2+转化成Fe3 +而中毒,服用维生素C可解除亚硝酸盐中毒,下列叙述中正确的是:
A.亚硝酸盐是还原剂
B.维生素C是还原剂
C.维生素C是氧化剂
D.亚硝酸盐被氧化
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com