
分析 (1)A.带有活塞的仪器使用前要检查是否漏水;
B.容量瓶用蒸馏水洗净后,再用待配液润洗,会导致所配溶液浓度偏大;
C.依据定容的正确操作解答;
D.容量瓶不能用来稀释浓溶液;
E.摇匀时食指顶住瓶塞,用另一只手的手指托住瓶底,把容量瓶倒转反复上下摇匀;
(2)由于容量瓶没有950mL规格,应用1000mL的容量瓶进行配制,然后根据m=cVM进行计算;
(3)①依据配制一定物质的量浓度溶液步骤选择需要的仪器;
②依据溶液稀释过程中溶质的物质的量不变计算需要浓硫酸的体积;
③依据浓硫酸稀释的正确操作解答;
(4)根据实验操作对物质的量浓度表达式c=$\frac{n}{V}$的影响进行判断.
解答 解:(1)A.带有活塞的仪器使用前要检查是否漏水,故A正确;
B.容量瓶用蒸馏水洗净后,再用待配液润洗,会导致所配溶液浓度偏大,故B错误;
C.定容时,应直接加蒸馏水到离刻度线1-2cm后改用胶头滴管逐滴滴加,故C错误;
D.容量瓶不能用来稀释浓溶液,故D错误;
E.摇匀时食指顶住瓶塞,用另一只手的手指托住瓶底,把容量瓶倒转反复上下摇匀,故E正确;
故选:BCD;
(2)容量瓶没有950mL规格,应用1000mL的容量瓶进行配制,则m(Na2CO3)=cVM=1L×2mol/L×106g/mol=212g,
故选A;
(3)①胶头滴管、500mL 容量瓶(2 分);
②设需要浓硫酸体积为V,则依据溶液稀释过程中溶质的物质的量不变得V×1.8mol/L=0.2mol/L×500mL,
解得V=55.6mL;
故答案为:55.6ml;
③稀释浓硫酸时,要把浓硫酸缓缓地沿器壁注入水中,同时用玻璃棒不断搅拌,以使热量及时地扩散;切不可把水注入浓硫酸中;
故答案为:浓硫酸先倒入烧杯,将水沿烧杯壁慢慢注入浓硫酸中,并不断搅拌;
(4)①用量筒量取浓硫酸时,仰视读数,导致量取的浓硫酸体积偏大,硫酸的物质的量偏大,溶液浓度偏大;
故答案为:偏大;
②定容时仰视读数,导致溶液体积偏大,溶液浓度偏小;
故答案为:偏小;
点评 本题考查了配制一定物质的量浓度的溶液的方法,明确配制原理及操作步骤是解题关键,注意误差分析的方法和技巧,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 减小压强 | B. | 升高温度 | C. | 增加SO2浓度 | D. | 加入催化剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1.5 mol/L | B. | 0.5mol/L | C. | 0.75 mol/L | D. | 0.25 mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 石油、沼气、天然气、植物油都属于可再生能源 | |
| B. | 应用盖斯定律,可计算某些难以直接测量的反应焓变 | |
| C. | 水蒸气变为液态水时放出的能量就是该变化的反应热 | |
| D. | 同温同压下,H2(g)+Cl2(g)═2HCl(g)在光照和点燃条件下的△H不同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金属钠存放在试剂瓶中的煤油里 | |
| B. | 存放液溴的试剂瓶中应加水封 | |
| C. | 硝酸应用棕色瓶盛装且避光存放 | |
| D. | 烧碱应盛放在玻璃塞的磨口玻璃瓶中 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
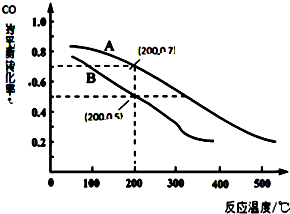 科学家开发出一种“洁净煤技术”,通过向地下煤层“气化炉”中交替鼓入空气和水蒸气的方法,连续产出高热值的煤炭气,其主要成分是CO和H2.“气化炉”中主要反应有:
科学家开发出一种“洁净煤技术”,通过向地下煤层“气化炉”中交替鼓入空气和水蒸气的方法,连续产出高热值的煤炭气,其主要成分是CO和H2.“气化炉”中主要反应有:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1000 mL,514.00 g | B. | 480 mL,198.72 g | ||
| C. | 500 mL,207.00 g | D. | 任意规格,207.00 g |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com