
(13分) Ⅰ(8分):已知Ca(OH)2与Cl2反应的氧化产物与温度有关,在一定量的石灰乳中通入足量的氯气,二者恰好完全反应。生成Cl-、ClO-、ClO3-三种含氯元素的离子,其中ClO-、ClO3-两种离子的物质的量(n)与反应时间(t)的曲线如图所示。
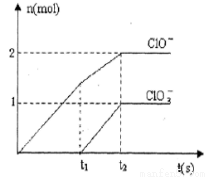
(1)t1时,开始有ClO3-生成的原因是_________________。
(2)t2时,Ca(OH)2与Cl2发生反应的总的化学方程式为 ___________________________。
(3)该石灰乳中含有Ca(OH)2的物质的量是_________mol。
(4)若反应物的量不变,在某温度下恰好完全反应时,氧化产物比值为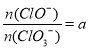 ,则n(Cl-)=____mol(用含a的代数式来表示)。
,则n(Cl-)=____mol(用含a的代数式来表示)。
Ⅱ(5分)下图中,是电解NO制备 NH4NO3,其工作原理如图所示,为使电解产物全部转化为NH4NO3。
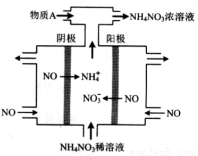
(1)阳极发生的电极反应式为 。
(2)需补充物质A,A是_____________,说明理由:________________。
Ⅰ、(8分)(1).反应放热使温度升高,在较高温度下可生成ClO3-(2分)
(2)10Cl2 +10Ca(OH)2=Ca(ClO3)2+2Ca(ClO)2+7CaCl2+10H2O(2分)
(3)5(1分) (4).(5a+25)/(a+3) (3分)
Ⅱ(5分)(1)NO—3e- + 2H2O == NO3-+4H+ (2分)
(2)NH3(1分);根据8NO+7H2O=3NH4NO3+2HNO3,电解产生的HNO3多。(2分)
【解析】
试题分析:I、(1)氯气与氢氧化钙在较高温度时生成氯酸根离子,t1时,开始有ClO3-生成,说明该反应放热,使温度升高,在较高温度下可生成ClO3-;
(2)t2时,Ca(OH)2与Cl2发生反应生成次氯酸根离子与氯酸根离子的物质的量分别是2mol、1mol,根据得失电子守恒,则Cl元素被还原为氯离子的物质的量是2mol+5mol=7mol,则方程式中次氯酸钙、氯酸钙、氯化钙的系数之比是2:1:7,同时产物中有水生成,配平该反应方程式,所以t2时,Ca(OH)2与Cl2发生反应的总的化学方程式为10Cl2 +10Ca(OH)2=Ca(ClO3)2+2Ca(ClO)2+7CaCl2+10H2O;
(3)根据图像判断,生成次氯酸根离子的物质的量是2mol,利用化学方程式中次氯酸钙与氢氧化钙的系数比可知,消耗的氢氧化钙的物质的量是5mol;
(4)设次氯酸根离子是amol,氯酸根离子是1mol,则Cl元素失去电子的总物质的量是amol+5mol=(a+5)mol,根据得失电子守恒,则Cl元素得到电子生成氯离子的物质的量是(a+5)mol。根据反应的化学方程式可知氯气的总物质的量是5mol,则Cl原子的物质的量是10mol,则氯离子在Cl元素中的百分比是(a+5)/(a+1+a+5)=(a+5)/(2a+6),所以n(Cl-)=10mol×a+5)/(2a+6)= (5a+25)/(a+3)mol;
II、(1)电解NO制备 NH4NO3,阳极发生氧化反应,根据装置图可知NO在阳极发生氧化反应,失去电子生成硝酸根离子,所以电极反应式是NO—3e- + 2H2O == NO3-+4H+;
(2)阴极NO被还原为铵根离子,电极反应式为NO+5e- + 6H+ =NH4++ H2O,根据得失电子守恒可知,阳极产生的硝酸根离子的物质的量大于阴极产生的铵根离子的物质的量,电解产生的HNO3多。总反应为8NO+7H2O=3NH4NO3+2HNO3,为使电解产物全部转化为NH4NO3,所以应补充NH3。
考点:考查氧化还原反应的分析与计算,对图像的分析,电解原理的应用


科目:高中化学 来源:2014-2015学年甘肃省高一上学期期中化学试卷(解析版) 题型:选择题
等质量的CH4和NH3相比较,下列结论错误的是
A.它们的分子个数比为17:16
B.它们的原子个数比为17:16
C.它们的氢原子个数比为17:12
D.它们所含氢元素的质量比为17:12
查看答案和解析>>
科目:高中化学 来源:2014-2015学年浙江省高三上学期期中考试化学试卷(解析版) 题型:填空题
(12分)近年来雾霾天气在秋冬季节经常肆虐我国中东部地区。其中,汽车尾气和燃煤是造成空气污染的原因之一。
(1)汽车尾气净化的主要原理为:2NO(g)+2CO (g)  2CO2 (g) +N2 (g)
2CO2 (g) +N2 (g)
在某密闭容器中发生该反应时,c(CO2)随温度(T)、催化剂的表面积(S)和时间(t)的变化曲线,如图所示。

据此判断:
①该反应的平衡常数表达式为 。
②该反应的ΔH 0(选填“>”、“<”)。
③当固体催化剂的质量一定时,增大其表面积可提高化学反应速率。若催化剂的表面积S1>S2,在右图中画出c(CO2)在T2、S2条件下达到平衡过程中的变化曲线。
(2)直接排放煤燃烧产生的烟气会引起严重的环境问题。
①煤燃烧产生的烟气含氮的氧化物,用CH4催化还原NOx可以消除氮氧化物的污染。
CH4(g)+2NO2(g) = N2(g)+CO2(g)+2H2O(g)  =-867kJ·mol-1
=-867kJ·mol-1
2NO2(g)  N2O4(g)
N2O4(g)  =-56.9kJ·mol-1
=-56.9kJ·mol-1
写出CH4催化还原N2O4(g)生成N2(g)、CO2(g)和H2O(g)的热化学方程式 。
②将燃煤产生的二氧化碳回收利用,可达到低碳排放的目的。右图是通过光电转化原理以廉价原料制备新产品的示意图。

写出上述光电转化过程的化学反应方程式 。催化剂a、b之间连接导线上电子流动方向是 (填a→b或b→a) 。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年浙江省高三上学期期中考试化学试卷(解析版) 题型:选择题
咖啡酸具有止血、镇咳、祛痰等疗效,其结构简式为 。下列有关咖啡酸的说法中,错误的是
。下列有关咖啡酸的说法中,错误的是
A.咖啡酸分子中的所有碳原子可能共平面
B.咖啡酸可以发生还原、酯化、加聚、显色等反应
C.1 mol咖啡酸可与4 mol Br2发生反应
D.1 mol咖啡酸与NaOH溶液反应最多消耗1 mol的NaOH
查看答案和解析>>
科目:高中化学 来源:2014-2015学年河南省焦作市高三上学期期中化学试卷(解析版) 题型:填空题
[选修五——基础有机化学](15分)
下图是以C7H8为原料合成某聚酰胺类物质(C7H5NO)n的流程图.
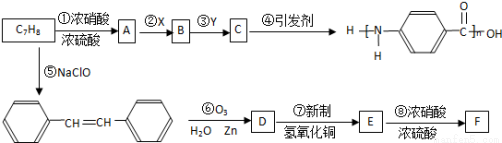
已知:Ⅰ.当苯环上已经有了一个取代基时,新引进的取代基因受原取代基的影响而取代其邻、对、间位的氢原子,使新取代基进入它的邻、对位的取代基有-CH3、-NH2等.使新取代基进入它的间位的取代基有-COOH、-NO2等.
Ⅱ.R-CH=CH-R′ R-CHO+R′-CHO;
R-CHO+R′-CHO;
Ⅲ.氨基(-NH2)易被氧化;硝基(-NO2)可被Fe和盐酸还原成氨基(-NH2).
回答下列问题:
(1)X、Y各是下列选项中的某一项,其中X是________.(填序号)
A.Fe和盐酸 B.酸性KMnO4溶液 C.NaOH溶液
(2)已知B和F互为同分异构体,写出物质F的结构简式:______________________________.
(3)分别写出D、E中的含氧官能团的名称__________________;______________________.
(4)对物质C的下列说法中,正确的是________(填写序号).
A.能发生酯化反应
B.能与溴水发生加成反应
C.只能和碱反应,不能和酸反应
(5)写出反应③、⑦的化学方程式,并注明反应类型
________________________________________________________;__________________.
________________________________________________________;__________________.
查看答案和解析>>
科目:高中化学 来源:2014-2015学年河南省焦作市高三上学期期中化学试卷(解析版) 题型:选择题
一定条件下,在体积为10 L的密闭容器中,1 mol A和1 mol B进行反应:
2A(g)+B(g) 2C(g),达到平衡时生成0.6 mol C。下列说法正确的是
2C(g),达到平衡时生成0.6 mol C。下列说法正确的是
A.当容器内密度保持不变时,可以判断反应已达平衡
B.其他条件不变,将容器体积变为20 L,C的平衡浓度变为原来的一半
C.其他条件不变,若增大压强,则物质A的转化率减小
D.达到平衡时,C的体积百分含量为0.353
查看答案和解析>>
科目:高中化学 来源:2014-2015学年河南省焦作市高三上学期期中化学试卷(解析版) 题型:选择题
假设SiO2原子晶体中Si原子被Al原子取代,不足的价数由K原子补充。当有25%的硅原子被铝原子取代时,可形成正长石,则正长石的化学组成为
A.KAlSiO4 B.KAlSi2O6 D.KAlSi3O8 D.KAlSi4O10
查看答案和解析>>
科目:高中化学 来源:2014-2015学年浙江省等四校高三上学期期中联考化学试卷(解析版) 题型:填空题
(5分)从含镁、钾盐湖水中蒸发最后得到产物中含光卤石(xKCl·yMgCl2·zH2O),它是制造钾肥和提取金属镁的重要原料,其组成可通过下列实验测定:
①准确称取5.550g样品溶于水,配成100.0mL溶液。
②将溶液分成二等份,在一份中加入足量的NaOH溶液至沉淀完全,过滤、洗涤、干
燥至恒重,得到白色固体0.580g。
③在另一份溶液中加入足量的硝酸酸化的AgNO3溶液至沉淀完全,过滤、洗涤、干燥至恒重,得到白色固体4.305g。
通过计算确定样品的组成。
(1)原样品中含Mg2+的物质的量为____________,
(2)原样品中含Cl—的物质的量为____________,
(3)光卤石的化学式为____ __ _。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年云南省高三上学期第二次月考化学试卷(解析版) 题型:选择题
用石墨做电极电解1 mol/L CuSO4溶液,当c(Cu2+)为0.5 mol/L时,停止电解,向剩余溶液中加入下列何种物质可使电解质溶液恢复至原来状况
A.CuSO4 B.CuO C.Cu(OH)2 D.CuSO4·5H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com