
某化学反应其△H== -122 kJ/mol,∆S== 231 J/(mol·K),则此反应在下列哪种情况下可自发进行
A.在任何温度下都能自发进行 B.在任何温度下都不能自发进行
C.仅在高温下自发进行 D.仅在低温下自发进行
科目:高中化学 来源:2015-2016学年安徽六安新安中学、南溪中学高一期中联考化学试卷(解析版) 题型:选择题
根据图中包含的信息分析,下列叙述正确的是 ( )
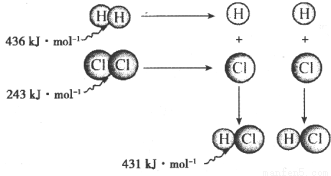
A.氢气与氯气反应生成1 mol氯化氢气体,反应吸收248 kJ的能量
B.436kJ•mol-1是指断开1 mol H2中的H—H键需要放出436 kJ的能量
C.氢气与氯气反应生成2 mol氯化氢气体,反应放出183 kJ的能量
D.431 kJ•mol-1是指生成2mol HCl中的H—Cl键需要放出431 kJ的能量
查看答案和解析>>
科目:高中化学 来源:2015-2016学年河北省邯郸市高一5月月考化学试卷(解析版) 题型:选择题
短周期主族元素X、Y、Z、W原子序数依次增大,X原子最外层有7个电子,Y原子最外层电子数是最内层电子数的一半,Z最高正价是最低负价绝对值的3倍。下列叙述正确的是( )
A.Y的离子半径比X的离子半径大
B.化合物Y2Z中既有离子键、又有共价键
C.Y、W最高价氧化物对应水化物的溶液均能溶解氧化铝
D.简单气态氢化物的稳定性由强到弱的顺序:Z、W、X
查看答案和解析>>
科目:高中化学 来源:2015-2016学年广西南宁市高二下学期期中化学试卷(解析版) 题型:选择题
室温时,CaCO3在水中的溶解平衡曲线如图所示,已知:25℃其溶度积为2.8×10-9 mol2·L-2,下列说法不正确的是

A.x数值为2×10-5
B.c点时有碳酸钙沉淀生成
C.加入蒸馏水可使溶液由d点变到a点
D.b点与d点对应的溶度积相等
*
查看答案和解析>>
科目:高中化学 来源:2015-2016学年广西南宁市高二下学期期中化学试卷(解析版) 题型:选择题
某溶液中由水电离出来的C(OH—)=10-12mol/L,则该溶液中的溶质不可能是
A.HCl B.NaOH C.NH4Cl D.H2SO4
查看答案和解析>>
科目:高中化学 来源:2016年全国普通高等学校招生统一考试化学(上海卷参考版) 题型:填空题
半水煤气是工业合成氨的原料气,其主要成分是H2、CO、CO2、N2和H2O(g)。半水煤气经过下列步骤转化为合成氨的原料。
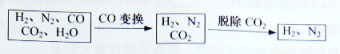
完成下列填空:
(1)半水煤气含有少量硫化氢。将半水煤气样品通入____溶液中(填写试剂名称),出现_______,可以证明有硫化氢存在。
(2)半水煤气在铜催化下实现CO变换:CO+H2O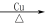 CO2+H2
CO2+H2
若半水煤气中V(H2):V(CO):V(N2)=38:28:22,经CO变换后的气体中:V(H2):V(N2)=____________。
(3)碱液吸收法是脱除二氧化碳的方法之一。已知:
Na2CO3 | K2CO3 | |
20℃碱液最高浓度(mol/L) | 2.0 | 8.0 |
碱的价格(元/kg) | 1.25 | 9.80 |
若选择Na2CO3碱液作吸收液,其优点是__________;缺点是____________。如果选择K2CO3碱液作吸收液,用什么方法可以降低成本?
___________________________________________
写出这种方法涉及的化学反应方程式。_______________________
(4)以下是测定半水煤气中H2以及CO的体积分数的实验方案。
取一定体积(标准状况)的半水煤气,经过下列实验步骤测定其中H2以及CO的体积分数。

①选用合适的无机试剂分别填入Ⅰ、Ⅰ、Ⅳ、Ⅴ方框中。
②该实验方案中,步骤________(选填“Ⅳ”或“Ⅴ”)可以确定半水煤气中H2的体积分数。
查看答案和解析>>
科目:高中化学 来源:2016年全国普通高等学校招生统一考试化学(上海卷参考版) 题型:选择题
已知:SO32-+I2+H2O→SO42-+2I-+2H+。某溶液中可能含有Na+、NH4+、Fe2+、K+、I-、SO32- 、SO42-,且所有离子物质的量浓度相等。向该无色溶液中滴加少量溴水,溶液仍呈无色。下列关于该溶液的判断正确的是
A.肯定不含I- B.肯定不含SO42-
C.肯定含有SO32- D.肯定含有NH4+
查看答案和解析>>
科目:高中化学 来源:2016年全国普通高等学校招生统一考试化学(上海卷参考版) 题型:选择题
下列化工生产过程中,未涉及氧化还原反应的是
A.海带提碘 B.氯碱工业
C.氨碱法制碱 D.海水提溴
查看答案和解析>>
科目:高中化学 来源:2015-2016年浙江宁波效实中学高一下期中化学卷(创)(解析版) 题型:选择题
在2 L的恒容密闭容器中,发生反应:A(g)+B(g)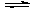 2C(g)+D(s)△H=-a kJ·mol-1,实验内容和结果分别如下表和下图所示。下列说法正确的是
2C(g)+D(s)△H=-a kJ·mol-1,实验内容和结果分别如下表和下图所示。下列说法正确的是

实验 序号 | 温度 | 起始物质的量 | 热量 变化 | |
A | B | |||
Ⅰ | 600℃ | 1 mol | 3 mol | 96 kJ |
Ⅱ | 800℃ | 0.5 mol | 1.5mol | —— |
A.实验Ⅰ中,10 min内平均速率v(B)=0.06 mol·L-1·min-1
B.600℃时,上述方程式中a=160
C.600 ℃时,该反应的平衡常数是0.45
D.向实验Ⅱ的平衡体系中再充入0.5 mol A和1.5 mol B,A的转化率将改变
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com