

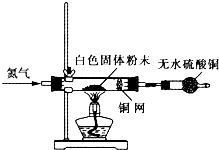
(1)M________,N________(填化学式)。
(2)a、c两处分别盛有黑色物质和白色物质,它们可能是________。b可能是________试剂。
(3)从双叉试管上部内壁,观察到的现象是________________,原因是________________(用化学方程式表示)。
(4)装置乙的作用是________________,离子方程式是________________。
 浙江名校名师金卷系列答案
浙江名校名师金卷系列答案科目:高中化学 来源: 题型:阅读理解
| 化学式 | Fe | FeO | Fe2O3 | Fe3O4 | Fe(OH)2 | Fe(OH)3 |
| 颜色 | 银白色 | 黑色 | 红色 | 黑色 | 白色 | 红褐色 |
查看答案和解析>>
科目:高中化学 来源:黄冈重点作业 高三化学(下) 题型:058
| |||||||||||||||||||||||
查看答案和解析>>
科目:高中化学 来源:黄冈重点作业 高三化学(下) 题型:058
| |||||||||||||||||||||||
查看答案和解析>>
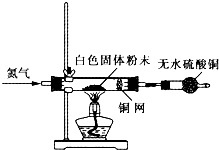
科目:高中化学 来源: 题型:解答题
| 化学式 | Fe | FeO | Fe2O3 | Fe3O4 | Fe(OH)2 | Fe(OH)3 |
| 颜色 | 银白色 | 黑色 | 红色 | 黑色 | 白色 | 红褐色 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com