
| A. | 在丙烯醛分子中,仅含有一种官能团 | |
| B. | 丙烯醛能使溴水褪色,但不能使酸性高锰酸钾溶液褪色 | |
| C. | 丙烯醛能发生加聚反应,生成高聚物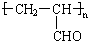 | |
| D. | 等物质的量的丙烯醛和丙醛完全燃烧,消耗等物质的量的O2 |
分析 该有机物中含有碳碳双键和醛基,具有烯烃和醛的性质,能发生加成反应、加聚反应、氧化反应等,据此分析解答.
解答 解:A.该有机物中含有醛基和碳碳双键两种官能团,故A错误;
B.碳碳双键能与溴发生加成反应、能被酸性高锰酸钾溶液氧化还,醛基能被溴、酸性高锰酸钾溶液氧化,所以丙烯醛能使溴水、酸性高锰酸钾溶液褪色,故B错误;
C.丙烯醛碳碳双键能发生加聚反应生成高分子化合物,生成高聚物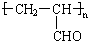 ,故C正确;
,故C正确;
D.1molCH2=CH-CHO消耗氧气为1mol×(3+$\frac{4}{4}$-$\frac{1}{2}$)=3.5mol,1molC3H6O消耗氧气为1mol×(3+$\frac{4}{4}$)=4mol,则等物质的量的丙烯醛和丙醛完全燃烧,消耗氧气的物质的量不等,故D错误;
故选C.
点评 本题考查有机物的结构与性质,为高频考点,把握官能团的判断及性质的关系为解答的关键,侧重烯烃和醛性质的考查,选项D为易错点.


 考前必练系列答案
考前必练系列答案科目:高中化学 来源: 题型:解答题
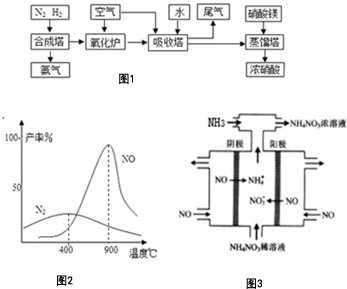 氨、硝酸、硝酸铵、硝酸铜是重要的化工产品.工业合成氨与制备硝酸一般可连续生产,流程如图1:请回答下列问题
氨、硝酸、硝酸铵、硝酸铜是重要的化工产品.工业合成氨与制备硝酸一般可连续生产,流程如图1:请回答下列问题查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 联合制碱法中循环使用CO2和NH3,以提高原料利用率 | |
| B. | 硫酸工业中,SO2氧化为SO3时采用常压,因为高压会降低SO2转化率 | |
| C. | 合成氨生产过程中将NH3液化分离,可加快正反应速率,提高N2、H2的转化率 | |
| D. | 炼钢是在高温下利用氧化剂把生铁中过多的碳和其他杂质氧化成气体或炉渣除去 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 钠是一种灰黑色、具有金属光泽、质地软的金属 | |
| B. | 氧化钠与过氧化钠的颜色不同 | |
| C. | 因为钠的性质非常活泼,故自然界中无游离态钠 | |
| D. | 过氧化钠可以做潜艇的供氧剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
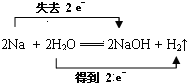 反应中,H2O是氧化剂.
反应中,H2O是氧化剂.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 已知:CH3CH2OH+NaBr+H2SO4(浓)$\stackrel{△}{→}$ CH3CH2Br+NaHSO4+H2O.
已知:CH3CH2OH+NaBr+H2SO4(浓)$\stackrel{△}{→}$ CH3CH2Br+NaHSO4+H2O.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
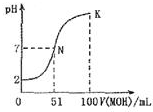 常温下,向100mL0.01mol•L-1 HA溶液中逐滴加入0.02mol-1 MOH溶液,图中所示曲线表示混合溶液的pH变化情况体积变化忽略不计).下列说法中不正确的是
常温下,向100mL0.01mol•L-1 HA溶液中逐滴加入0.02mol-1 MOH溶液,图中所示曲线表示混合溶液的pH变化情况体积变化忽略不计).下列说法中不正确的是| A. | MOH为一元弱碱 | |
| B. | MA 稀溶液PH<7 | |
| C. | N点水的电离程度大于K点水的电离程度 | |
| D. | K点对应的溶液的PH=10,则C(MOH)+C(OH)-C(H+=0.01mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 钠硫电池以熔融金属钠、熔融硫和多硫化钠(Na2Sx)分别作为两个电极的反应物,固体Al2O3陶瓷(可传导Na+)为电解质,其反应原理如图所示:
钠硫电池以熔融金属钠、熔融硫和多硫化钠(Na2Sx)分别作为两个电极的反应物,固体Al2O3陶瓷(可传导Na+)为电解质,其反应原理如图所示:| 物质 | Na | S | Al2O3 |
| 熔点/℃ | 97.8 | 115 | 2050 |
| 沸点/℃ | 892 | 444.6 | 2980 |
| A. | 放电时,电极A为负极 | |
| B. | 根据上表数据,请你判断该电池工作的适宜温度应控制在350℃~2050℃ | |
| C. | 放电时,Na+的移动方向为从电极A到电极B | |
| D. | 充电时,总反应为Na2Sx═2Na+xS(3<x<5),则阳极的电极反应式为Sx2--2e-═xS |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com