
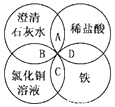
 铁、稀硫酸、Ba(OH)2溶液、CuSO4溶液是中学化学常见的物质,这四种物质间的反应关系如图所示,图中两圆相交部分(A、B、C、D)表示物质之间可能发生的反应,请回答下列问题:
铁、稀硫酸、Ba(OH)2溶液、CuSO4溶液是中学化学常见的物质,这四种物质间的反应关系如图所示,图中两圆相交部分(A、B、C、D)表示物质之间可能发生的反应,请回答下列问题:分析 (1)单质与化合物发生置换反应,则化合物与化合物一定不发生置换反应;
(2)B为石灰水与氯化铜反应,生成氢氧化铜和氯化钙;
(3)D为稀盐酸与Fe反应,生成氯化亚铁和氢气;
(4)除去CuCl2溶液中的稀盐酸,选CuO,CuO与HCl反应生成氯化铜和水,且不引入新杂杂质.
解答 解:(1)A、B均为化合物之间的反应,不能发生置换反应,故答案为:AB;
(2)B为石灰水与氯化铜反应,生成氢氧化铜和氯化钙,离子反应为Cu2++2OH-=Cu(OH)2↓,故答案为:Cu2++2OH-=Cu(OH)2↓;
(3)D为稀盐酸与Fe反应,生成氯化亚铁和氢气,离子反应为Fe+2H+=Fe2++H2↑,故答案为:Fe+2H+=Fe2++H2↑;
(4)除去CuCl2溶液中的稀盐酸需要加入适量的试剂为CuO或Cu(OH)2等,若选CuO,CuO与HCl反应生成氯化铜和水,且不引入新杂杂质,反应为CuO+2HCl=CuCl2+H2O,故答案为:CuO;CuO+2HCl=CuCl2+H2O.
点评 本题考查酸碱盐的性质及反应,为高频考点,把握物质的性质、发生的反应为解答的关键,侧重分析与应用能力的考查,注意元素化合物知识的应用,题目难度不大.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 乙炔 | B. | 1,3-丁二烯 | C. | 环己烷 | D. | 乙烯 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
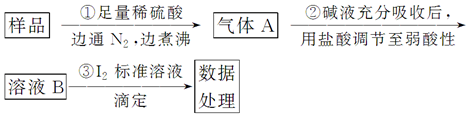
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
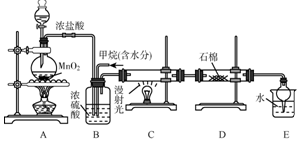 利用甲烷与氯气发生取代反应制取副产品盐酸的设想在工业上已成为现实.某化学兴趣小组在实验室中模拟上述过程,其设计的模拟装置如图:
利用甲烷与氯气发生取代反应制取副产品盐酸的设想在工业上已成为现实.某化学兴趣小组在实验室中模拟上述过程,其设计的模拟装置如图:查看答案和解析>>
科目:高中化学 来源: 题型:实验题
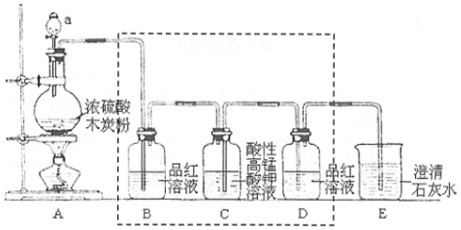
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
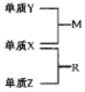 X、Y、Z是三种短周期元素,原子半径的大小为:K(Y)>r(X)>r(Z),三种元素的原子序数之和为15;X、Y、Z三种元素的常见单质在适当条件下可发生如图转化关系,其中 R为10电子分子,是一种常见的无机溶剂.下列说法中不正确的是( )
X、Y、Z是三种短周期元素,原子半径的大小为:K(Y)>r(X)>r(Z),三种元素的原子序数之和为15;X、Y、Z三种元素的常见单质在适当条件下可发生如图转化关系,其中 R为10电子分子,是一种常见的无机溶剂.下列说法中不正确的是( )| A. | X元素位于周期表中第16列 | |
| B. | X、Y、Z元素两两之间均能形成原子个数比为1:1的化合物 | |
| C. | X、Y、Z元素形成的单质均具有强还原性 | |
| D. | R的沸点高于M的沸点 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 铜版画的一种制版方法.以沥青涂于薄铜板表面作防腐膜,用刀刻去防腐膜作画,然后放在FeCl3腐蚀液中.刮去膜之处被腐蚀,形成凹线.印刷时凹线可储油墨,在铜版机纸压制下油墨吸于纸上,形成典雅、庄重的铜版画.
铜版画的一种制版方法.以沥青涂于薄铜板表面作防腐膜,用刀刻去防腐膜作画,然后放在FeCl3腐蚀液中.刮去膜之处被腐蚀,形成凹线.印刷时凹线可储油墨,在铜版机纸压制下油墨吸于纸上,形成典雅、庄重的铜版画.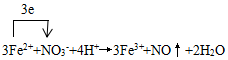 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金属性:Na>Mg | B. | 酸性:H2SO4>H2SiO3 | ||
| C. | 稳定性:HCl>HBr | D. | 同浓度溶液的碱性:Na2CO3>NaHCO3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com