
钒具有众多优异的性能,用途十分广泛,有金属“维生素”之称。完成下列填空:
(1)将废钒催化剂(主要成分V2O5)与稀硫酸、亚硫酸钾溶液混合,充分反应,所得溶液显酸性、含VO2+、K+ 、SO42–等。写出该反应的化学方程式 。
(2)向上述所得溶液中加入KClO3溶液,充分反应后,溶液中新增加了VO2+、Cl– 。写出并配平该反应的离子方程式,并标出电子转移的数目和方向 。
(3)在20.00mL的0.1mol/LVO2+溶液中,加入0.195g锌粉,恰好完成反应,则还原产物可能是 。
a.V b.V2+ c.VO2+ d.VO2+
(4)已知V2O5能和盐酸反应生成氯气和VO2+。请再写一个离子反应方程式,说明还原性:SO32–>Cl–>VO2+ 。
(1)V2O5 +K2SO3+2H2SO4→2VOSO4+K2SO4+2H2O (2分)
(写成离子方程式也给分 V2O5 + SO32–+4H+→2VO2++ SO42–+2H2O )
(2)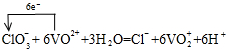 (配平1分,电子转移的数目及方向1分)
(配平1分,电子转移的数目及方向1分)
(3)b(2分)
(4)Cl2 + SO32–+ H2O→2Cl–+ 2H++ SO42–(2分)
【解析】
试题分析:(1)由题意可知,V2O5与稀硫酸、亚硫酸钾反应生成VOSO4、K2SO4,根据原子守恒可知还生成H2O。其中V的化合价从+5价降低到+4价,得到1个电子。亚硫酸钾中S元素的化合价从+4价升高到+6价,失去2个电子,因此根据电子得失守恒可知,氧化剂与还原剂的物质的量之比是1:1,所以配平后方程式为V2O5+K2SO3+2H2SO4=2VOSO4+K2SO4+2H2O。
(2)ClO3-与VO2+反应生成VO2+、Cl-,氯元素化合价由+5价降低为-1价,共降低6价。V元素化合价由+4升高为+5价,共升高1价,化合价升降最小公倍数为6,故ClO3-的系数为1、VO2+系数为6,由原子守恒可知成VO2+的系数为6,Cl-的系数为1,由电荷守恒可知还生成H+,系数为6,故有水参加反应,系数为3,因此配平该反应的离子方程式,并标出电子转移的数目和方向为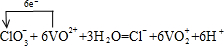 。
。
(3)0.195g锌粉的物质的量=0.195g÷65g/mol=0.003mol,设V元素在还原产物中的化合价为a,则根据电子得失守恒可知0.003×2=0.02L×0.1mol/L×(5-a),解得a=2,答案选b。
(4)在氧化还原反应中还原剂的还原性强于还原产物的,V2O5能和盐酸反应生成氯气和VO2+,故还原性Cl->VO2+,氯气可以将亚硫酸根氧化生成硫酸根、自身被还原为Cl-,可以说明还原性SO32->Cl-,反应离子方程式为Cl2+SO32-+H2O=2Cl-+2H++SO42-。
考点:考查氧化还原反应的有关判断、配平和计算等


科目:高中化学 来源: 题型:


查看答案和解析>>
科目:高中化学 来源:上海市杨浦区2013年高考一模化学试题 题型:022
钒具有众多优异的性能,用途十分广泛,有金属“维生素”之称.
完成下列填空:
1.将废钒催化剂(主要成分V2O5)与稀硫酸、亚硫酸钾溶液混合,充分反应,所得溶液显酸性、含VO2+、K+、SO42-等.写出该反应的化学方程式________.
2.向上述所得溶液中加入KClO3溶液,充分反应后,溶液中新增加了VO2+、Cl-.写出并配平该反应的离子方程式,并标出电子转移的数目和方向________.
3.在20.00 mL的0.1 mol/L VO2+溶液中,加入0.195 g锌粉,恰好完成反应,则还原产物可能是________.
a.V
b.V2+
c.VO2+
d.VO2+
4.已知V2O5能和盐酸反应生成氯气和VO2+.请再写一个离子反应方程式,说明还原性:SO32->Cl->VO2+________.
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com