��2009?�Ϻ�һģ��ij��γ�С������50mLNaOH��Һ����CO
2���壬�Ʊ�Na
2CO
3��Һ��Ϊ�˷�ֹͨ���CO
2�����������NaHCO
3�����������ʵ�鲽�裺
a��ȡ25mL NaOH��Һ���չ�����CO
2���壬��CO
2���岻���ܽ⣻
b��С�������Һ1��2min��
c���ڵõ�����Һ�м�����һ�루25mL��NaOH��Һ��ʹ���ֻ�Ϸ�Ӧ��
��1���˷������Ƶýϴ�����Na
2CO
3��д��a��c�����Ļ�ѧ��Ӧ����ʽ
NaOH+CO2�TNaHCO3
NaOH+CO2�TNaHCO3
��
NaHCO3+NaOH�TNa2CO3+H2O
NaHCO3+NaOH�TNa2CO3+H2O
��
�˷�����һ����ʵ��װ����ͼ��ʾ��
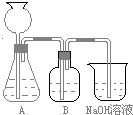
��2�����뷴Ӧ��ǰ����μ������װ�õ������ԣ�
�õ��ɼм�סA��B���Ӵ����ȼ��A�������ԣ�������Ƥ������©��ע��һ������ˮ��ʹ©���е�ˮ�������ƿ�ڵ�ˮ�棬ֹͣ��ˮ��©��������ƿ�е�Һ���ֲ��䣬˵��װ�ò�©����Ȼ����B�������ԣ����ձ���ע������ˮ��ʹ���ܿ�����ˮ�У�˫����ס���ƿƬ��������ð�����ɿ��ֺ�������ˮ���뵼���γ�ˮ����˵��װ�ò�©����Ҳ��һ�μ��A��B�������ԣ����Ӻ��ձ�����齺����ֹˮ�м�ס��Ȼ���©��ע��һ������ˮ��ʹ©���е�ˮ�������ƿ�ڵ�ˮ�棬��һ�ᣬ�۲�©��������ƿ�е�Һ�������ֲ��䣬˵��װ�ò�©������
�õ��ɼм�סA��B���Ӵ����ȼ��A�������ԣ�������Ƥ������©��ע��һ������ˮ��ʹ©���е�ˮ�������ƿ�ڵ�ˮ�棬ֹͣ��ˮ��©��������ƿ�е�Һ���ֲ��䣬˵��װ�ò�©����Ȼ����B�������ԣ����ձ���ע������ˮ��ʹ���ܿ�����ˮ�У�˫����ס���ƿƬ��������ð�����ɿ��ֺ�������ˮ���뵼���γ�ˮ����˵��װ�ò�©����Ҳ��һ�μ��A��B�������ԣ����Ӻ��ձ�����齺����ֹˮ�м�ס��Ȼ���©��ע��һ������ˮ��ʹ©���е�ˮ�������ƿ�ڵ�ˮ�棬��һ�ᣬ�۲�©��������ƿ�е�Һ�������ֲ��䣬˵��װ�ò�©������
��3��װ��B��ʢ�ŵ��Լ���
������������Һ
������������Һ
��������
����HCl����
����HCl����
��
��4����ʵ����ͨ���Ʒ��У�װ��A������Ϊ����
�ڢܢ�
�ڢܢ�
����ķ���װ�ã�����ţ���
��CH
2�TCH
2 ��H
2S ��CH
4 ��CH��CH ��H
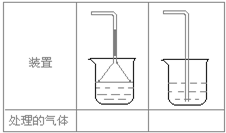
2��5��ʵ������ȡ�������壺��NH
3����Cl
2����HCl����H
2S����CH
4����CO����CO
2����O
2ʱ�����ڱ������β����������������ͼ��ʾװ�ý��д����ģ���������������װ��ͼ���·��ո��ڣ�
��6����֪����NaOH��Һ�����ʵ���������Ϊ40%�������¸��� Һ�ܶ�Ϊ1.44g/mL�����跴Ӧǰ����Һ��������䣬������ʵ���������ô��ַ����Ʊ�����Na
2CO
3��Һ�����ʵ���Ũ��Ϊ
7.2 mol/L
7.2 mol/L
��





