
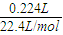 =0.01mol,质量为:m(NH4+)=0.01mol×18g/mol=0.18g,
=0.01mol,质量为:m(NH4+)=0.01mol×18g/mol=0.18g,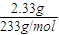 =0.01mol,
=0.01mol,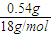 =0.03mol,
=0.03mol,

科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源:江西省白鹭洲中学2009-2010学年高一下学期第一次月考化学试题 题型:038
某结晶水合物是一种复盐,含有两种阳离子和一种阴离子.称取两份质量均为1.96 g的该结晶水合物,分别制成溶液.一份加入足量Ba(OH)2溶液,生成白色沉淀,随即沉淀转变为灰绿色,最后变为红褐色,用足量稀盐酸处理沉淀物,经洗涤和干燥,得到白色固体2.33 g.另一份加入含0.001 mol KMnO4的酸性溶液,MnO4-恰好全部被还原为Mn2+.
加热该结晶水合物,产生能使湿润的红色石蕊试纸变蓝的气体
请回答以下问题:
(1)该结晶水合物中含有的两种阳离子是________和________.
(2)1.96 g结晶水合物中阴离子的物质的量为________.
(3)求该结晶水合物的化学式(写出计算过程).
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com