
| 元素代号 | X | Y | Z | M | R | Q | |
| 原子半径(×10-10 m) | 1.86 | 0.99 | 1.43 | 1.60 | 0.75 | 0.74 | |
| 主要化合价 | 最高正价 | +1 | +7 | +3 | +2 | +5 | -- |
| 最低负价 | -- | -1 | -- | -- | -3 | -2 | |
| A. | 离子半径r(R3-)>r(X+)>r(Z3+) | |
| B. | 元素X和Q形成的化合物中不可能含有共价键 | |
| C. | Q2-比R3-更容易失去电子 | |
| D. | Y的含氧酸的酸性一定比R的含氧酸的酸性强 |
分析 由短周期元素的原子半径及主要化合价可知,Y存在+7、-1价,则Y为Cl,Q只有-2价,则Q为O,R与Q的半径接近,且R存在+5、-3价,则R为N,X、Z、M均只有正价,且原子半径大于O、Cl的原子半径,则应分别为第三周期的Na、Al、Mg,然后结合元素周期律及元素化合物知识来解答.
解答 解:由短周期元素的原子半径及主要化合价可知,Y存在+7、-1价,则Y为Cl,Q只有-2价,则Q为O,R与Q的半径接近,且R存在+5、-3价,则R为N,X、Z、M均只有正价,且原子半径大于O、Cl的原子半径,则应分别为第三周期的Na、Al、Mg,
A.具有相同电子排布的离子,原子序数大的离子半径小,则离子半径r(R3-)>r(X+)>r(Z3+),故A正确;
B.元素X和Q形成的化合物可能为Na2O2,存在O-O非极性共价键,故B错误;
C.非金属性Q>R,则R3-比Q2-更容易失去电子,故C错误;
D.高氯酸为所有含氧酸中酸性最强的酸,则Y的最高价含氧酸的酸性一定比R的含氧酸的酸性强,故D错误;
故选A.
点评 本题考查原子结构与元素周期律的关系,为高频考点,把握元素的性质、元素周期律等为解答的关键,侧重分析与应用能力的考查,注意元素周期律的应用,题目难度不大.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | 等质量的聚乙烯(PE)和乙烯完全燃烧消耗氧气的量相等 | |
| B. | 废弃的PE和PVC均可回收利用以减少白色污染 | |
| C. | 将PVC薄膜放入试管中加强热,产生的气体可使湿润的蓝色石蕊试纸变红 | |
| D. | PVC的单体可由PE的单体与氯化氢加成制得 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实 验 操 作 | 结 论 |
| A | 用容量瓶配制溶液时,若定容摇匀后液面低于刻度线,补加水至与刻度线相平 | 所配溶液浓度不受影响 |
| B | 用湿润的pH试纸测定氯水的pH | 所测溶液的pH偏大 |
| C | 取少量试液于试管中,加入浓NaOH溶液并加热,用湿润的红色石蕊试纸检验产生的气体 | 若红色石蕊试纸变蓝 则所取溶液含NH4+ |
| D | 用托盘天平称取一定质量的NaCl固体,左盘放砝码,右盘放固体 | 所称NaCl质量一定偏小 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Ag2O作正极,被氧化 | |
| B. | 若将电解液换成酸性溶液,使用寿命会缩短 | |
| C. | Zn作正极,被还原 | |
| D. | OH-向正极移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
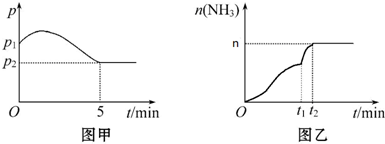
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
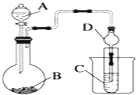 某化学兴趣小组为探究元素性质的递变规律,设计了如下系列实验.
某化学兴趣小组为探究元素性质的递变规律,设计了如下系列实验.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
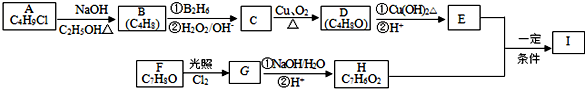
 ;
; ;
; .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com