
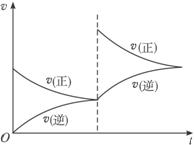
A.增大压强 B.升高温度
C.增大O2浓度 D.减小SO3浓度
科目:高中化学 来源: 题型:

据图可知:
(1)该反应的正反应是____________(填“吸”或“放”)热反应。
(2)反应方程式中气体物质的化学计量数的关系是:m+n=___________p+q(填“>”“<”或“=”)。
查看答案和解析>>
科目:高中化学 来源:2010年重庆一中高一下学期期末考试化学试题 题型:选择题
下列有关化学平衡状态的说法中正确的是
A.当可逆反应达到平衡状态时,v正 = v逆 = 0
B.当可逆反应达到平衡状态时,每种成分的质量分数保持不变
C.对于已达平衡的可逆反应,延长反应时间能提高反应物的转化率
D.对于已达平衡的可逆反应,改变外界条件时其平衡状态不会改变
查看答案和解析>>
科目:高中化学 来源:专项题 题型:实验题
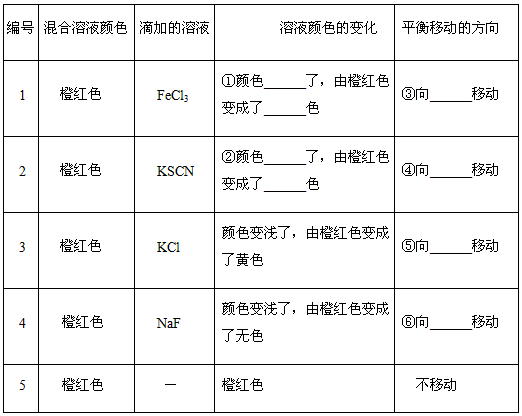
 Fe(SCN)3,加入KCl固体,颜色不应该有变化,但现象却是变浅了,请你分析变浅的可能原因是_____________________。
Fe(SCN)3,加入KCl固体,颜色不应该有变化,但现象却是变浅了,请你分析变浅的可能原因是_____________________。 查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关化学平衡状态的说法中正确的是
A.当可逆反应达到平衡状态时,v正 = v逆 = 0
B.当可逆反应达到平衡状态时,每种成分的质量分数保持不变
C.对于已达平衡的可逆反应,延长反应时间能提高反应物的转化率
D.对于已达平衡的可逆反应,改变外界条件时其平衡状态不会改变
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com