
| A.原子序数:Y > X > Z |
| B.碱性:XOH > Y(OH)3 |
| C.单质的还原性:X > Y |
| D.离子半径:X+ > Y3+ > Z2- |
科目:高中化学 来源:不详 题型:填空题
| 元素 | 相关结构和性质 |
| A | A为非金属元素,其一种单质是电的良导体,难熔、质软并有润滑性,可用作电极材料 |
| B | 是蛋白质的组成元素之一,原子核外有三种不同能量的电子,且未成对电子数最多 |
| C | 其单质既能与强酸溶液应又能与强碱溶液反应,其简单离子在第三周期单核离子中半径最小 |
| D | D的高价氯化物的盐溶液常用于印刷电路极电路的“刻蚀” |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| 氟化物 | NaF | MgF2 | SiF4 |
| 熔点/℃ | 1266 | 1534 | 183 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 I研究G蛋白偶联受体,下列说法正确的是
I研究G蛋白偶联受体,下列说法正确的是| A.I元素的质量数是131 | B.I元素的中子数是78 |
| C.I原子5p亚层有一个未成对电子 | D.I原子有53个能量不同的电子 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| 元素代号 | I1 | I2 | I3 | I4 |
| Q | 2080 | 4000 | 6100 | 9400 |
| R | 500 | 4600 | 6900 | 9500 |
| S | 740 | 1500 | 7700 | 10500 |
| T | 580 | 1800 | 2700 | 11600 |
| U | 420 | 3100 | 4400 | 5900 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:推断题
 2BF3(g),若将平衡体系中各物质的浓度都增加到原来的2倍,则产生的结果是______________________(填序号)。
2BF3(g),若将平衡体系中各物质的浓度都增加到原来的2倍,则产生的结果是______________________(填序号)。查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.H35Cl、H37Cl属于同素异形体 |
| B.16O与18O的中子数不同,核外电子排布却相同 |
| C.稳定性:CH4>SiH4;还原性:HCl> H2S |
D.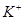 、 、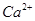 、 、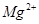 的离子半径依次增大,还原性依次增强 的离子半径依次增大,还原性依次增强 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| 元素代号 | X | Y | Z | M | N | P |
| 原子半径/nm | 0.186 | 0.143 | 0.075 | 0.074 | 0.152 | 0.099 |
| 元素的主要化合价 | +1 | +3 | +5、-3 | -2 | +1 | +7、-1 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| 第一组 | He -268.8 | (a) -249.5 | Ar -185.8 | Kr -151.7 |
| 第二组 | F2 -187.0 | Cl2 -33.6 | (b) 58.7 | I2 184.0 |
| 第三组 | (c) 19.4 | HCl -84.0 | HBr -67.0 | HI -35.3 |
| 第四组 | H2O 100.0 | H2S -60.2 | (d) -42.0 | H2Te -1.8 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com