
Fe、Co、Ni、Cu等金属能形成配合物与这些金属原子的电子层结构有关.
(1)基态Ni原子的核外电子排布式为________,基态Cu原子的价电子排布式为________.
(2)Fe(CO)5常温下呈液态,熔点为-20.5℃,沸点为103℃,易溶于非极性溶剂,据此可判断Fe(CO)5晶体属于________(填晶体类型).
科目:高中化学 来源: 题型:阅读理解
| A-B | A=B | A≡B | |
| CO | 357.7 | 798.9 | 1071.9 |
| N2 | 154.8 | 418.4 | 941.7 |
查看答案和解析>>
科目:高中化学 来源: 题型:
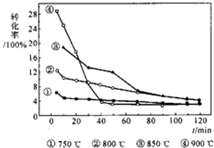 ?C(s)+2H2(g),如图是温度对甲烷转化率的影响,下列有关说法正确的是( )
?C(s)+2H2(g),如图是温度对甲烷转化率的影响,下列有关说法正确的是( )查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| A-B | A=B | A≡B | |
| C≡O | 357.7 | 798.9 | 1071.9 |
| N≡N | 154.8 | 418.4 | 941.7 |


查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| A-B | A=B | A≡B | ||||
CO |
键能(KJ/mol) | 357.7 | 798.9 | 1071.9 | ||
| 键能差值(KJ/mol) | 441.2 | 273 | ||||
| N2 | 键能(KJ/mol) | 154.8 | 418.4 | 941.7 | ||
| 键能差值(KJ/mol) | 263.6 | 523.3 | ||||
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com