
【题目】右表为元素周期表中短周期的一部分,Y元素最高正价与最低负价的代数和为4,下列叙述正确的是
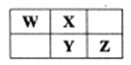
A. 原子半径: W B. 元素的非金属性:X>Y>Z
C. 氢化物的热稳定性:W>X D. 氧化物对应水化物的酸性: Y
科目:高中化学 来源: 题型:
【题目】NaCl是一种化工原料,可以制备一系列物质,如下图所示。下列说法正确的是

A. 石灰乳与Cl2的反应中,Cl2既是氧化剂又是还原剂
B. 25℃时,NaHCO3 在水中的溶解度比Na2CO3 大
C. Cl2与过量的铁反应生成FeCl2
D. 图示转化反应都是氧化还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家积极探索新技术对CO2进行综合利用。
Ⅰ.CO2可用来合成低碳烯烃:2CO2(g)+6H2(g)![]() CH2=CH2(g)+4H2O(g) △H=akJ/mol
CH2=CH2(g)+4H2O(g) △H=akJ/mol
请回答:
(1)已知:H2和CH2=CH的燃烧热分别是285.8kJ/mol和1411.0kJ/mol,且H2O(g)![]() H2O((1)△H=-44.0kJ/mol,则a=________kJ/mol。
H2O((1)△H=-44.0kJ/mol,则a=________kJ/mol。
(2)上述由CO2合成CH2=CH2的反应在________下自发进行(填“高温”或“低温”)。
(3)在体积为1L的恒容密闭容器中,充入3molH2和1molCO2,测得温度对CO2的平衡转化率和催化剂催化效率的影响如图1所示。下列说法正确的是________。
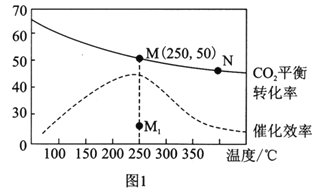
A.平衡常数大小:KMN
B.其他条件不变,若不使用催化剂,则250℃时CO2的平衡转化率可能位于点M1
C.图1中M点时,乙烯的体积分数为7.7%
D.当压强或n(H2)/n(CO2)不变时均可证明化学反应已达到平衡状态
(4)保持温度不变,在体积为V L的恒容容器中以n(H2)∶n(CO2)=3∶1的投料比加入反应物,t0时达到化学平衡。请在图2中作出容器内混合气体的平均相对分子质量![]() 随时间变化的图象。___________
随时间变化的图象。___________
Ⅱ.利用“Na-CO2”电池将CO2变废为宝。我国科研人员研制出的可充电“Na-CO2”电池,以钠箔和多壁碳纳米管(MWCNT)为电极材料,总反应为4Na+3CO2![]() 2Na2CO3+C。放电时该电池“吸入”CO2,其工作原理如图3所示:
2Na2CO3+C。放电时该电池“吸入”CO2,其工作原理如图3所示:
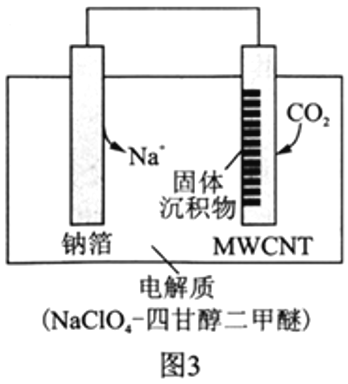
(5)放电时,正极的电极反应式为__________________。
(6)若生成的Na2CO3和C全部沉积在正极表面,当转移0.2mole-时,正极增加的质量为_______g。
(7)选用高氯酸钠四甘醇二甲醚做电解液的优点是_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)氯化铵的水溶液显弱酸性,其原因为___________________(用离子方程式表示),0.1 molL-1的氨水中加入少量的NH4Cl固体,溶液的pH________(填“升高”或“降低”);若加入少量的明矾,溶液中的NH4+的浓度__________(填“增大”或“减小”);
(2)25℃,两种酸的电离平衡常数如下表。
化学式 | CH3COOH | H2CO3 | HCN | HClO | H2SO3 |
电离常数 | 1.8×10-5 | K1=4.3×10-7 K2=5.6×10-11 | 5×10-10 | 3.0×10-8 | K1=2×10-2 K2=1×10-7 |
①物质的量浓度均为0.1 mol/L的四种溶液:
a.CH3COONa b.Na2CO3 c.NaClO d.NaHCO3
pH由大到小的顺序为__________(用编号填写)。
②根据上表数据判断,下列离子方程式错误的是__________。
A.CO2(过量)+H2O+ClO-=HCO3-+HClO B.SO2(过量)+H2O+ClO-=HSO3-+HClO
C.CO2(少量)+H2O+CN-=HCO3-+HCN D.SO2(少量)+H2O+CN-=HSO3-+HCN
E.SO2(少量)+2CO32-+H2O=SO32-+2HCO3- F.2SO2(过量)+CO32-+H2O=2HSO3-+CO2↑
③0.10 molL-1Na2SO3溶液中离子浓度由大到小的顺序为___________________。
④25℃时,NaCN与HCN的混合溶液,若c(CN-)=c(HCN),则溶液中pH=__________(已知lg2=0.3,lg5=0.7)。
⑤25℃时,若向NaHSO3溶液中加入少量的I2,则溶液中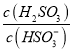 将__________(填“增大”“减小”或“不变”)。
将__________(填“增大”“减小”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学实验室需要0.2mol/L NaOH溶液500mL和0.5mol/L硫酸溶液450mL.根据这两种溶液的配制情况回答下列问题:
(1)如图所示的仪器中配制溶液肯定不需要的是________(填序号),配制上述溶液还需用到的玻璃仪器是________(填仪器名称).
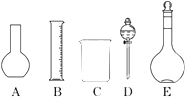
(2)容量瓶是配制溶液的主要仪器,容量瓶上标有以下六项中的________(填写序号).
①温度 ②浓度 ③容量 ④压强 ⑤酸式或碱式 ⑥刻度线
(3)配制时,其正确的操作顺序是(用字母表示,每个字母只能用一次)________.
A.用30mL水洗涤烧杯2~3次,洗涤液均注入容量瓶
B.准确称取计算量的氢氧化钠固体于烧杯中,再加入少量水(约50mL),用玻璃棒慢慢搅动,使其充分溶解,冷却到室温
C.将容量瓶盖紧,摇匀
D.将溶解的氢氧化钠溶液沿玻璃棒注入容量瓶中
E.改用胶头滴管加水,使溶液凹液面恰好与刻度相切
F.继续往容量瓶内小心加水,直到液面接近刻度2~3cm处
(4)根据计算,配制0.2mol/L NaOH溶液500mL需 NaOH固体的质量为:________g.
(5)配制过程中需先在烧杯中将浓硫酸进行稀释,稀释时操作方法是:________.
(6)将所配制的稀H2SO4进行测定,发现实际浓度小于0.5mol/L.请你分析下列哪些操作会引起所配浓度偏小(填写字母)_______ .
A.用量筒量取浓硫酸时,仰视量筒的刻度
B.容量瓶未干燥即用来配制溶液
C.浓硫酸在烧杯中稀释后,未冷却就立即转移到容量瓶中,并进行定容
D.往容量瓶转移时,有少量液体溅出
E.在容量瓶中定容时俯视容量瓶刻度线
F.烧杯未进行洗涤
G.定容后塞上瓶塞反复摇匀,静置后,液面不到刻度线,再加水至刻度线.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】环己烯粗品中含有环己醇和少量酸性杂质等。加入饱和食盐水,振荡、静置、分层,环己烯在_________层(填"上"或"下"),分液后再用_________洗涤(填入编号)。已知:
密度(g/cm3) | 熔点(℃) | 沸点(℃) | 溶解性 | |
环己醇 | 0.96 | 25 | 161 | 能溶于水 |
环己烯 | 0.81 | -103 | 83 | 难溶于水 |
A.KMnO4溶液 B.稀H2SO4 C. Na2CO3溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(题文)为了探究三种气态氧化物(SO2、NO2、CO2)的性质,某同学设计了一组实验:
(1)实验一:探究三种气体在水中的溶解性,用三支相同的试管收集满三种气体,倒置在盛满水的烧杯中,一段时间后,观察到的现象如图A,B,C所示。
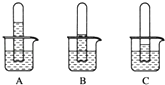
(i)在相同条件下,三种气体在水中溶解度最大的是_____,写出A烧杯中发生反应的化学方程式:________。
(2)实验二:用三只集气瓶收集满二氧化硫、二氧化氮气体,然后将其倒置在水槽中.分别缓慢通入适量O2或Cl2,如图D,E,F所示.一段时间后,D,E装置的集气瓶中充满溶液,F装置的集气瓶中还有气体剩余。
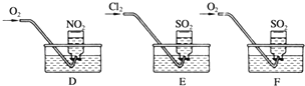
(ii)实验二中装置D的集气瓶最终充满溶液(假设瓶内液体不扩散):
①写出装置D中总反应的化学方程式:________。
②假设该实验条件下,气体摩尔体积为aLmol﹣1,则装置D的集气瓶中所得溶液溶质的物质的量浓度为_____。
(iii)实验前在F装置的水槽里滴加几滴紫色石蕊试液,观察到的现象是________,通入氧气后,可能观察到的实验现象是________,写出反应的化学方程式:________。
(iv)溶液充满集气瓶后,在E装置的水槽里滴加硝酸钡溶液,写出有关反应的离子方程式________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com