


 亮点激活精编提优100分大试卷系列答案
亮点激活精编提优100分大试卷系列答案科目:高中化学 来源: 题型:
| 改变条件 | 新平衡与原平衡比较 | |
| A | 增大压强 | N2的浓度一定变小 |
| B | 升高温度 | N2的转化率变小 |
| C | 充入一定量H2 | H2的转化率不变,N2的转化率变大 |
| D | 使用适当催化剂 | NH3的体积分数增大 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验编号 | 操 作 | 现 象 |
I |
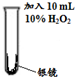 |
剧烈反应,有大量无色气体产生,该气体可以使带火星的木条复燃;反应停止后,试管内壁上的银全部溶解,得到澄清液体a. |
| 实验编号 | 操 作 | 现 象 |
Ⅱ |
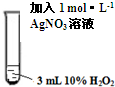 |
振荡,溶液无明显现象. |
Ⅲ |
 |
剧烈反应,产生大量无色气体,同时在试管底部仍有少量黑色固体. |
| 实验步骤和操作 | 实验现象及结论 |
| 取3mL 10% H2O2在试管中,加入少量Ag2O,充分反应后, |
查看答案和解析>>
科目:高中化学 来源: 题型:
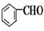 +CH3CHO
+CH3CHO| NaOH溶液 |
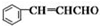 +H2O
+H2O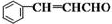 侧链上可能发生反应的类型:
侧链上可能发生反应的类型:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
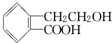 ,它可通过不同化学反应分别制得B、C和D三种物质.
,它可通过不同化学反应分别制得B、C和D三种物质.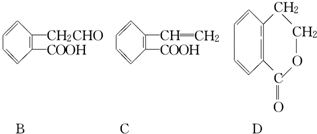
查看答案和解析>>
科目:高中化学 来源: 题型:
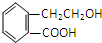 ,它可通过不同化学反应分别制得B、C、D和E四种物质.
,它可通过不同化学反应分别制得B、C、D和E四种物质.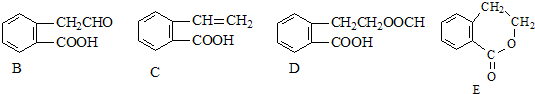
查看答案和解析>>
科目:高中化学 来源: 题型:
A、NaCl的电子式: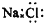 |
| B、乙烯的结构式:CH2=CH2 |
C、S2-结构示意图: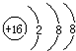 |
D、CH4分子的球棍模型: |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com