
进行化学实验,观察实验现象,通过分析推理得出正确的结论是化学学习的方法之一。下列说法正确的是
A.浓硝酸在光照条件下变黄,说明浓硝酸不稳定,生成的有色产物能溶于浓硝酸
B.在KI淀粉溶液中通入氯气,溶液变蓝,说明氯气能与淀粉发生显色反应
C.在某溶液中加入硝酸酸化的氯化钡溶液,有白色沉淀生成,说明溶液中含SO42—
D.将铜片放入浓硫酸中,无明显实验现象,说明铜在冷的浓硫酸中发生钝化
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:2014-2015学年河南省焦作市高三上学期期中化学试卷(解析版) 题型:选择题
下列物质中既能跟稀H2SO4反应, 又能跟氢氧化钠溶液反应的是
①NaHCO3 ②Al2O3 ③Al(OH)3 ④(NH4)2S
A.③④ B.②③④ C.①③④ D.全部
查看答案和解析>>
科目:高中化学 来源:2014-2015学年云南省高三上学期第二次月考化学试卷(解析版) 题型:选择题
【化学——选修3:物质结构与性质】(15分)
(1)含碳物质不完全燃烧会产生CO。血红蛋白中含有Fe2+,CO易与血红蛋白结合成稳定的配合物而使人中毒,写出铁离子(Fe3+)的核外电子排布式为 ,CO有多种等电子体,其中常见的一种分子是 。利用CO可以合成化工原料COCl2、配合物Fe(CO)5等,已知一个COCl2分子中每个原子最外层都形成8电子的稳定结构,则一个COCl2分子内含有 个δ键,C原子的杂化方式为 。Fe(CO)5等在一定条件下分解生成CO和铁,反应过程中断裂的化学键是 ,形成的化学键是 。
(2)A、B均为短周期金属元素。依据下表数据,回答问题:
电离能/kJ·mol-1 | I1 | I2 | I3 | I4 |
A | 932 | 1 821 | 15 390 | 21 771 |
B | 738 | 1 451 | 7 733 | 10 540 |
写出A原子的电子排布图 ,Al原子的第一电离能 (填:“大于”、“小于”或“等于”)738 kJ·mol-1,原因是 。
(3)下图是一种镍(Ni)镧(La)合金储氢后的晶胞结构图。该合金储氢后,含0.5mol Ni的合金可吸附氢气的体积(标况)为 。

查看答案和解析>>
科目:高中化学 来源:2014-2015学年云南省高三上学期第二次月考化学试卷(解析版) 题型:选择题
设NA为阿伏加德罗常数的值。下列说法正确的是
A.1L 1mol·L-1的NaClO 溶液中含有ClO-的数目为NA
B.标准状况下,一定量的铜与硝酸反应后生成22.4 L NO、NO2、N2O4的混合气体,则被还原的硝酸的分子数大于NA
C.铁做电极电解食盐水,若阴极得到NA个电子,则阳极产生11.2L气体(标况下)
D.标准状况下,6.72L NO2与水充分反应转移的电子数目为0.1NA
查看答案和解析>>
科目:高中化学 来源:2014-2015学年陕西省高三上学期第二次模考试化学试卷(解析版) 题型:填空题
(12分)A、B、C、D均为中学化学常见的纯净物,A是单质。它们之间有如下的反应关系:

图G5?2
(1)若A是淡黄色固体,C、D是氧化物,C是造成酸雨的主要物质,但C也有其广泛的用途,写出其中的2个用途:__________________________。
(2)若B是气态氢化物,C、D是氧化物且会造成光化学烟雾污染。B与C在一定条件下反应生成的A是大气的主要成分,写出该反应的化学方程式:__________________________________。
(3)若D物质具有两性,②、③反应均要用强碱溶液,④反应时通入过量的一种引起温室效应的主要气体。判断单质A的元素在周期表中的位置:__________________。
(4)若A是太阳能电池用的光伏材料。C、D为钠盐,两种物质中钠、氧外的元素为同一主族,且溶液均显碱性。写出②反应的化学方程式:____________________。D的化学式是______。
(5)若A是应用最广泛的金属。④反应用到A,②、⑤反应均用到同一种非金属单质。C的溶液用于蚀刻印刷铜电路板,写出该反应的离子方程式:_______________________________。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年陕西省高三上学期第二次模考试化学试卷(解析版) 题型:选择题
下列说法错误的是
A.碳、硫单质在加热条件下都能与浓硝酸、浓硫酸发生反应
B.氮氧化物、二氧化硫是形成酸雨的主要物质
C.二氧化硫具有还原性,因此二氧化硫不能用浓硫酸干燥
D.硅在自然界中主要以氧化物和硅酸盐的形式存在
查看答案和解析>>
科目:高中化学 来源:2014-2015学年陕西省高三上学期第二次模考试化学试卷(解析版) 题型:选择题
钠铝合金(常温液态)可作为核反应堆的载热介质。下列说法错误的是
A.该合金的熔点低于金属钠的熔点
B.若将钠铝合金投入水中得到无色溶液且无固体剩余,则n(Na)≥n(Al)
C.若将钠铝合金投入FeCl3溶液中有Fe(OH)3沉淀生成
D.等质量的钠铝合金中铝的含量越大,与足量盐酸反应时放出的氢气越少
查看答案和解析>>
科目:高中化学 来源:2014-2015学年辽宁省高三上学期期中化学试卷(解析版) 题型:填空题
(6分)
(1)在微生物作用的条件下,NH4+经过两步反应被氧化成NO3—。两步反应的能量变化示意图如下:
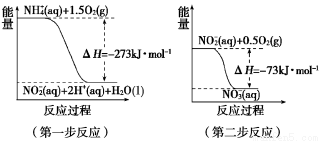
1 mol NH4+ (aq) 全部氧化成NO3—(aq)的热化学方程式是_______________。
(2)、电解NO制备 NH4NO3,其工作原理如图所示,

写出该电解池的电极反应式
阳极: __________________________ 阴极:________________________________
查看答案和解析>>
科目:高中化学 来源:2014-2015学年江苏省泰州市姜堰区高三上学期期中化学试卷(解析版) 题型:填空题
(20分)三氯化铬是化学合成中的常见物质,三氯化铬易升华,在高温下能被氧气氧化。制备三氯化铬的流程如下图所示:
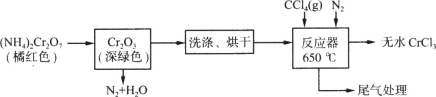
(1)重铬酸铵分解产生的三氧化二铬(Cr2O3难溶于水)需用蒸馏水洗涤,如何用简单方法判断其已洗涤干净? 。
(2)已知CCl4沸点为76.8℃,为保证稳定的CCl4气流,适宜的加热方式是 。
(3)用下图装置制备CrCl3时,
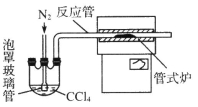
反应管中发生的主要反应为: Cr2O3+3CCl4==2CrCl3+3COCl2,则向三颈烧瓶中通入N2的作用为:
① ;
② 。
(4)样品中三氯化铬质量分数的测定:称取样品0.3000g,加水溶解并定容于250mL容量瓶中。移取25.00mL于碘量瓶(一种带塞的锥形瓶)中,加热至沸后加入1g Na2O2,充分加热煮沸,适当稀释,然后加入过量2mol·L–1H2SO4至溶液呈强酸性,此时铬以Cr2O72–存在,再加入1.1g KI,加塞摇匀,充分反应后铬以Cr3+存在,于暗处静置5min后,加入1mL指示剂,用0.0250mol·L–1标准Na2S2O3溶液滴定至终点,平行测定三次,平均消耗标准Na2S2O3溶液21.00mL。(已知:2Na2S2O3+I2 == Na2S4O6+2NaI)
①滴定实验可选用的指示剂名称为 ,判定终点的现象是 ;若滴定时振荡不充分,刚看到局部变色就停止滴定,则会使样品中无水三氯化铬的质量分数的测量结果 (填“偏高”“偏低”或“无影响”)。
②加入Na2O2后要加热煮沸,其主要原因是 。
③加入KI时发生反应的离子方程式为 。
④样品中无水三氯化铬的质量分数为 。(结果保留一位小数)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com