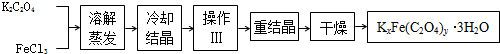
解:I.(1)由题目信息可知,化合物K
xFe(C
2O
4)
y?zH
2O(Fe为+3价)是一种光敏感材料,推知黑暗是为了防止晶体见光分解.
故答案为:黑暗可以防止晶体分解.
(2)操作Ⅲ前一步是冷却结晶,结晶后自然要将晶体与母液分离,所以需要过滤,晶体表面有吸附的杂质,洗涤后再进行重结晶提纯.
故答案为:过滤、洗涤.
Ⅱ.(3)配制250mL 0.10mol?L
-1KMnO
4溶液,由已有的仪器可知,还需要250mL容量瓶;
由已有的仪器可知,滴定实验还需要滴定管,KMnO
4溶液有强氧化性,可以发生橡皮管,需用酸式滴定管盛放;
该实验是氧化还原滴定,终点时KMnO
4溶液恰好过量一滴,溶液会显紫红色,30秒内不变色.
故答案为:250mL容量瓶、酸式滴定管; 紫红.
(4)由MnO
4-+5Fe
2++8H
+=Mn
2++5Fe
3++4H
2O可知,n(Fe
3+)=5n(MnO
4-)=5×0.002L×0.10mol?L
-1=0.001mol,由2KMnO
4+5H
2C
2O
4+3H
2SO
4=2MnSO
4+K
2SO
4+10CO
2↑+8H
2O可知,n(C
2O
42-)=

n(MnO
4-)=

×0.012L×0.10mol?L
-1=0.003mol,所以0.001mol:0.003mol=1:y,解得y=3,根据化合价代数和为0可知,x+3+3×(-2)=0,解得x=3,由铁元素守恒可知,化合物K
xFe(C
2O
4)
y?zH
2O等于Fe
3+的物质的量为0.001mol,所以计算该化合物摩尔质量为
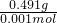
=491g/mol,所以
3×39+56+3×88+18z=491,解得z=3,故该化合物的化学式为K
3Fe(C
2O
4)
3?3H
2O.
故答案为:K
3Fe(C
2O
4)
3?3H
2O.
分析:I.(1)由题目信息可知,化合物K
xFe(C
2O
4)
y?zH
2O(Fe为+3价)是一种光敏感材料,推知黑暗是为了防止晶体见光分解.
(2)操作Ⅲ前一步是冷却结晶,结晶后自然要将晶体与母液分离,所以需要过滤,晶体表面有吸附的杂质,洗涤后再进行重结晶提纯.
Ⅱ.(3)题目中明确说道包含物质的量溶液配制和滴定实验,所以需要容量瓶和滴定管,关键是要准确写出“250mL容量瓶”.而KMnO
4溶液有强氧化性,需用酸式滴定管盛放.终点颜色的判断,需要准确理解该滴定实验的原理,该实验是氧化还原滴定,终点时KMnO
4溶液恰好过量一滴,溶液会显紫红色.
(4)由MnO
4-+5Fe
2++8H
+=Mn
2++5Fe
3++4H
2O可知,n(Fe
3+)=5n(MnO
4-),由2KMnO
4+5H
2C
2O
4+3H
2SO
4=2MnSO
4+K
2SO
4+10CO
2↑+8H
2O可知n(C
2O
42-)=

n(MnO
4-),根据化学式,可求得y的值,根据化合价代数和为0计算xx的值,由铁元素守恒可知,
化合物K
xFe(C
2O
4)
y?zH
2O等于Fe
3+的物质的量,计算该化合物摩尔质量,进而计算z的值,据此书写化学式.
点评:考查学生对工艺流程理解、阅读获取信息能力、溶液配制、氧化还原反应滴定与计算等,难度中等,需要学生具备阅读分析能力和灵活运用知识的解决问题能力.


 n(MnO4-)=
n(MnO4-)= ×0.012L×0.10mol?L-1=0.003mol,所以0.001mol:0.003mol=1:y,解得y=3,根据化合价代数和为0可知,x+3+3×(-2)=0,解得x=3,由铁元素守恒可知,化合物KxFe(C2O4)y?zH2O等于Fe3+的物质的量为0.001mol,所以计算该化合物摩尔质量为
×0.012L×0.10mol?L-1=0.003mol,所以0.001mol:0.003mol=1:y,解得y=3,根据化合价代数和为0可知,x+3+3×(-2)=0,解得x=3,由铁元素守恒可知,化合物KxFe(C2O4)y?zH2O等于Fe3+的物质的量为0.001mol,所以计算该化合物摩尔质量为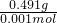 =491g/mol,所以
=491g/mol,所以 n(MnO4-),根据化学式,可求得y的值,根据化合价代数和为0计算xx的值,由铁元素守恒可知,
n(MnO4-),根据化学式,可求得y的值,根据化合价代数和为0计算xx的值,由铁元素守恒可知,