
【题目】有机物A只含有C、H、O三种元素,常用作有机合成的中间体。16.8 g该有机物经燃烧生成44.0 g CO2和14.4 g H2O;质谱图表明其相对分子质量为84,红外光谱分析表明A分子中含有O-H键和-C≡C-H,核磁共振氢谱上有三个峰,峰面积之比为6∶1∶1。
(1)A的分子式是 。
(2)下列物质中,一定条件下能与A发生反应的是 。
a.H2 b.Na c.酸性KMnO4溶液 d.Br2
(3)A的结构简式是 。
(4)有机物B是A的同分异构体,能发生银镜反应,1 mol B最多能与2 mol H2加成。B中所有碳原子一定处于同一个平面,请写出所有符合条件的B的结构简式(不考虑立体异构) 、 。
【答案】(1)C5H8O(2)abcd(3)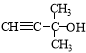 (4)(CH3)2 C=CHCHO CH3CH=C(CH3)CHO
(4)(CH3)2 C=CHCHO CH3CH=C(CH3)CHO
【解析】
试题设A分子式为CxHyOz,根据题意知A的相对分子质量为84,16.8gA的物质的量为0.2mol,0.2 mol A燃烧可以得到1 mol CO2、0.8 mol H2O,故x=5、y=8,又因A的相对分子质量为84,求得z=1,则A的分子式为C5H8O;(2)分析A的分子式知其不饱和度为2,红外光谱分析表明A分子中含有O-H键和-C≡C-H,核磁共振氢谱上有三个峰,峰面积之比为6∶1∶1,推测出A的结构简式为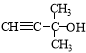 。(3)A分子中含有碳碳三键,能与H2、Br2发生加成反应,能与KMnO4溶液发生氧化反应,含有—OH,能与Na反应,故选a、b、c、d。(4)A的不饱和度是2,B是A的同分异构体,可能为两个环或一个环和一个双键或两个双键,又B能发生银镜反应,含有醛基;1 mol B最多能与2 mol H2加成,则该有机物中必含有一个碳碳双键;又所有碳原子在同一平面上,碳碳双键上共连有三个含碳基团,则B的结构简式为其中两个是甲基(—CH3),另一个集团中含碳氧双键,所以B的结构简式为:(CH3)2 C=CHCHO或CH3CH=C(CH3)CHO。
。(3)A分子中含有碳碳三键,能与H2、Br2发生加成反应,能与KMnO4溶液发生氧化反应,含有—OH,能与Na反应,故选a、b、c、d。(4)A的不饱和度是2,B是A的同分异构体,可能为两个环或一个环和一个双键或两个双键,又B能发生银镜反应,含有醛基;1 mol B最多能与2 mol H2加成,则该有机物中必含有一个碳碳双键;又所有碳原子在同一平面上,碳碳双键上共连有三个含碳基团,则B的结构简式为其中两个是甲基(—CH3),另一个集团中含碳氧双键,所以B的结构简式为:(CH3)2 C=CHCHO或CH3CH=C(CH3)CHO。


 期末宝典单元检测分类复习卷系列答案
期末宝典单元检测分类复习卷系列答案科目:高中化学 来源: 题型:
【题目】N2O5是一种新型硝化剂,其性质和制备受到人们的关注。一定温度下,在2 L固定容积的密闭容器中发生反应:2N2O5(g)![]() 4NO2(g)+O2(g) ΔH>0。反应物和部分生成物的物质的量随反应时间变化的曲线如图所示。下列说法中不正确
4NO2(g)+O2(g) ΔH>0。反应物和部分生成物的物质的量随反应时间变化的曲线如图所示。下列说法中不正确

A. 曲线a表示NO2的物质的量随时间的变化
B. 10 s时,v(正)>v(逆)
C. 20 s时反应达到平衡
D. 0~20 s内平均反应速率 v(O2)=0.05 mol·L-1·s-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作或装置正确的是

A. 利用图1所示装置吸收制取少量二氧化硫产生的尾气
B. 利用图2所示装置制取乙烯
C. 利用图3所示装置证明H2CO3酸性强于苯酚
D. 利用图4所示装置制备乙酸乙酯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能源是国民经济发展的重要基础,我国目前使用的能源主要是化石燃料。
(1)已知: ![]()
![]()
![]()
则煤气化主要反应![]() ________________
________________
(2)已知![]() 的正反应速率为
的正反应速率为![]() ,逆反应速率为
,逆反应速率为![]() ,k为速率常数。2500K时,
,k为速率常数。2500K时, ![]() ,则该温度下的反应平衡常数K=_________________ 。
,则该温度下的反应平衡常数K=_________________ 。
(3)甲醇制甲醚的有关反应为: ![]() 一定温度下,在三个容积均为1.0 L的恒容密闭容器中发生该反应。
一定温度下,在三个容积均为1.0 L的恒容密闭容器中发生该反应。
容器编号 | 温度/℃ | 起始物质的量/mol | 平衡物质的量/mol | |
CH3OH | CH3OCH3 | H2O | ||
I | 387 | 0. 20 | x | |
II | 387 | 0. 40 | y | |
Ⅲ | 207 | 0. 20 | 0. 090 | 0. 090 |
![]() ________________.
________________.
②已知![]() 时该反应的化学平衡常数K=4。该温度下,若起始时向容器I中充入0.10mol
时该反应的化学平衡常数K=4。该温度下,若起始时向容器I中充入0.10mol ![]() ,则反应将向_________(填“正”或“逆”)反应方向进行。
,则反应将向_________(填“正”或“逆”)反应方向进行。
③容器Ⅱ中反应达到平衡后,若要进一步提高甲醚的产率,可以采取的措施为______________(填序号)
A.升高温度 B.其他条件不变,增加![]() 的物质的量
的物质的量
C.降低温度 D.保持其他条件不变,通入氖气
(4)为减少雾霾、降低大气中有害气体含量,研究机动车尾气中![]() 及
及![]() 的排放量意义重大。机动车尾气污染物的含量与空/燃比(空气与燃油气的体积比)的变化关系示意图如图所示:
的排放量意义重大。机动车尾气污染物的含量与空/燃比(空气与燃油气的体积比)的变化关系示意图如图所示:

①当空/燃比达到15后![]() 减少的原因可能是__________(填字母)。
减少的原因可能是__________(填字母)。
a.反应![]() 是吸热反应
是吸热反应
b.当空/燃比大干15后,燃油气燃烧放出的热量相应减少
②随空/燃比增大,CO和![]() 的含量减少的原因是______。
的含量减少的原因是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】药物贝诺酯可由乙酰水杨酸和对乙酰氨基酚在一定条件下反应制得:

(1) 贝诺酯分子式为
(2) 对乙酰氨基酚在空气易变质,原因是 。
(3) 用浓溴水区别乙酰水杨酸和对乙酰氨基酚,方案是否可行 (填“可行”或“不可行”)。
(4)写出乙酰水杨酸与足量氢氧化钠溶液反应的化学方程式 。
(5)实验室可通过两步反应,实现由乙酰水杨酸制备 ,请写出两步反应中依次所加试剂的化学式 、 。
,请写出两步反应中依次所加试剂的化学式 、 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镍废料中主要含有Ni,还有少量的Cu、Fe、Pb等。现从中制取Ni2O3,可用于制造人造卫星、宇宙飞船的高能电池,也可用于制成镍镉碱性电池。生产流程见下:

已知0.010 mol/L金属离子在不同pH下的沉淀情况如下:
Fe3+ | Cu2+ | Ni2+ | Fe2+ | |
开始沉淀pH | 3.0 | 5.0 | 7.4 | 9.7 |
完全沉淀pH | 4.0 | 6.5 | 9.0 | 11 |
回答下列问题:
(1)加入碳酸钙调pH的目的是___________________,“沉渣2”的主要成分是_____,必须先过滤“沉渣1”后再进行“除Cu”的原因是______________。
(2)用离子方程式解释加入NH4F “除Ca”的过程________________。
(3)“酸浸”时参与反应的H2SO4与HNO3物质的量比保持为3:2,此时Ni单质所发生的化学方程式为_______。
(4)“操作X”是________、________
(5)向NiO中加入盐酸溶解,待完全溶解后,加入足量NaOH溶液,再加入NaClO溶液,写出其中和NaClO相关的反应的离子方程式为__________________。
(6)根据上表数据,计算当0.010 mol/L NiSO4溶液中Ni2+完全沉淀时的c(Ni2+)= ____mol/L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】刚结束的两会《政府工作报告》首次写入“推动充电、加氢等设施的建设”。如图是一种正负电极反应均涉及氢气的新型“全氢电池”,能量效率可达80%。下列说法中错误的是

A. 该装置将化学能转换为电能
B. 离子交换膜允许H+和OH-通过
C. 负极为A,其电极反应式是H2-2e- + 2OH- = 2H2O
D. 电池的总反应为H+ + OH-![]() H2O
H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应mX(g)+nY(g)qZ(g),△H<0,m+n>q,在恒容密闭容器中反应达到平衡时,下列有关说法正确的是( )
A. 如果继续通入一定量某气体使体系压强增大,平衡将正向移动
B. 此时,X的正反应速率是Y的逆反应速率的π/n倍
C. 如果降低温度,且保持物质状态不发生改变,混合气体的平均相对分子质量变小
D. 如果增加X的物质的量,平衡正向移动,X的转化率增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于热化学反应的描述中正确的是
A. HCl和NaOH反应的中和热△H=-57.3 kJ·mol1,则H2SO4和Ca(OH)2反应的中和热△H=2×(-57.3)kJ·mol1
B. 甲烷的标准燃烧热ΔH=-890.3 kJ·mol1,则CH4(g)+2O2(g)=CO2(g)+2H2O(g) ΔH<-890.3 kJ·mol1
C. 已知:500℃、30MPa下,N2(g)+3H2(g)![]() 2NH3(g) ΔH=-92.4kJ·mol-1;将1.5 mol H2和过量的N2在此条件下充分反应,放出热量46.2 kJ
2NH3(g) ΔH=-92.4kJ·mol-1;将1.5 mol H2和过量的N2在此条件下充分反应,放出热量46.2 kJ
D. CO(g)的燃烧热是283.0kJ·mol1,则2CO2(g) ===2CO(g)+O2(g)反应的△H=+566.0 kJ·mol1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com