
下列有关铁及其化合物的有关说法中正确的是( )
A.Fe3O4为红棕色晶体
B.铁与水蒸气在高温下的反应产物为Fe2O3和H2
C.除去FeCl3溶液中的FeCl2杂质可以向溶液中通入氯气
D.Fe3+与KSCN试剂反应产生红色沉淀
 ABC考王全优卷系列答案
ABC考王全优卷系列答案科目:高中化学 来源: 题型:
在一定温度下,反应A2(g) + B2(g) 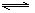 2AB(g)达到平衡的标志是
2AB(g)达到平衡的标志是
A、单位时间内生成nmolA2同时生成nmolAB
B、容器内的总物质的量不随时间变化
C、单位时间内生成2nmolAB的同时生成nmolB2
D、单位时间内生成nmolA2的同时生成nmolB2
查看答案和解析>>
科目:高中化学 来源: 题型:
钒有金属“维生素”之称,研究发现钒的某些化合物对治疗糖尿病有很好的疗效。
工业上设计将VOSO4中的K2SO4、SiO2、CuO杂质除去并回收得到V2O5的流程如下:
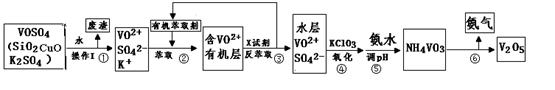
请回答下列问题:
(1)步骤②、③的变化过程可表示为(HM为有机萃取剂):
VOSO4 (水层)+ 2HM(有机层)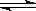 VOM2(有机层) + H2SO4 (水层)
VOM2(有机层) + H2SO4 (水层)
步骤②中萃取时必须加入适量碱,其原因是 。
步骤③中X试剂为 。
(2)步骤④的离子方程式为
(3)该工艺流程中,可以循环利用的物质有 和 。
(4)操作Ⅰ得到的废渣,用 溶解,充分反应后, ,(填写系列操作名称)称量得到mg氧化铜。
(5)为了制得氨水,甲、乙两小组选择了不同方法制取氨气,请将实验装置的字母编号和制备原理填写在下表空格中。
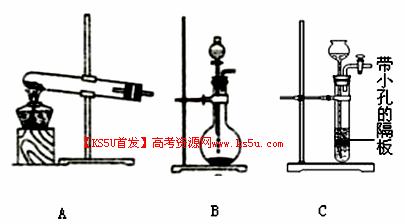
| 实验装置 | 实验药品 | 制备原理 | |
| 甲小组 | A | 氢氧化钙、氯化铵 | 反应的化学方程式为① |
| 乙小组 | ② | 浓氨水、氢氧化钠固体 | 分析产生氨气的原因③ |
查看答案和解析>>
科目:高中化学 来源: 题型:
1NaHSO3溶液在不同温度下均可被过量KIO3氧化,当NaHSO3完全消耗即有I2析出,依据I2析出所需时间可以求得NaHSO3的反应速率。将浓度均为0.020 mol·L-1的NaHSO3溶液(含少量淀粉)10.0 mL、KIO3(过量)酸性溶液40.0 mL混合,记录10~55 ℃间溶液变蓝时间,55 ℃时未观察到溶液变蓝,实验结果如下图。据图分析,下列判断不正确的是( )

A.40 ℃之前与40 ℃之后溶液变蓝的时间随温度的变化趋势相反
B.图中b、c两点对应的NaHSO3反应速率相等
C.图中a点对应的NaHSO3反应速率为5.0×10-5 mol·L-1·s-1
D.温度高于40 ℃时,淀粉不宜用作该实验的指示剂
查看答案和解析>>
科目:高中化学 来源: 题型:
一定温度下,在某2 L恒容密闭容器中加入纳米级Cu2O并通入0.1 mol H2O(g),发生反应:2H2O(g) 2H2(g)+O2(g) ΔH=+484 kJ·mol-1,不同时间产生O2的物质的量见下表:
2H2(g)+O2(g) ΔH=+484 kJ·mol-1,不同时间产生O2的物质的量见下表:
| 时间/min | 20 | 40 | 60 | 80 |
| n(O2)/mol | 0.001 0 | 0.001 6 | 0.002 0 | 0.002 0 |
下列说法正确的是( )
A.达到平衡时,需要从外界吸收的能量为0.968 kJ
B.前20 min内的平均反应速率v(H2O)=2.5×10-5mol·L-1·min-1
C.增大c(H2O),可以提高水的分解率
D.使用颗粒更小的纳米级Cu2O,可以增大平衡时O2的体积分数
查看答案和解析>>
科目:高中化学 来源: 题型:
下列离子方程式中正确的是( )
A.用FeCl3溶液腐蚀铜制印刷电路板:Fe3++Cu===Fe2++Cu2+
B.NH4HCO3溶液和过量的NaOH溶液相混合:HCO +OH-===CO
+OH-===CO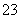 +H2O
+H2O
C.向Fe2(SO4)3的酸性溶液中通入足量H2S:Fe3++H2S===FeS↓+2H+
D.FeI2溶液中通入Cl2至I-恰好完全被氧化:2I-+Cl2===I2+2Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
某课外研究小组,用含有较多杂质的铜粉,通过不同的化学反应精制CuO,其设计的实验过程为:

图93
(1)杂铜经灼烧后得到的产物是氧化铜及少量铜的混合物,灼烧后含有少量铜的可能原因是________________________________________________________________________。
a.灼烧过程中部分氧化铜被还原
b.灼烧不充分铜未被完全氧化
c.氧化铜在加热过程中分解生成铜
d.该条件下铜无法被氧气氧化
(2)由粗制氧化铜通过两种途径制取纯净CuO,与途径Ⅰ相比,途径Ⅱ有明显的两个优点是________________________________________________________________________
________________________________________________________________________。
(3)有同学指出,由CuSO4溶液到生成CuO少了一个环节,即应先生成Cu(OH)2沉淀,过滤洗涤后再加热分解Cu(OH)2得CuO。以下说法不可能成为减少该环节的理由的是________。
A.CuO比Cu(OH)2颗粒粗大,更易于过滤从溶液中分离
B.Cu(OH)2分解温度较低,加热其浊液即可使其分解
C.干态下分解Cu(OH)2,温度难以控制,可能因温度过高导致CuO进一步分解生成Cu2O
D.过滤分离出的CuO不需洗涤就已非常纯净
查看答案和解析>>
科目:高中化学 来源: 题型:
经测定由甲醛(HCHO)和乙酸乙酯(C4H8O2) 组成的混合物中氧的质量分数为16%,则此混合物中氢的质量分数是
A.12% B. 78% C.72% D.13%
查看答案和解析>>
科目:高中化学 来源: 题型:
将11.9 g由Mg、Al、Fe组成的合金溶于足量的NaOH溶液中,合金质量减少了2.7 g。另取等质量的合金溶于过量稀硝酸中,生成了6.72 L NO(标准状况下),向反应后的溶液中加入适量NaOH溶液恰好使Mg2+、Al3+、Fe3+完全转化为沉淀,则沉淀的质量为( )
A.22.1 g B.27.2 g C.30 g D.无法计算
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com