
.(12分)由等物质的量的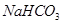 和
和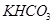 组成的混合物18.400 g,与100 mL盐酸反应。(题中涉及的气体体积均为标准状况下,填空时可以用带字母的式子表示。)
组成的混合物18.400 g,与100 mL盐酸反应。(题中涉及的气体体积均为标准状况下,填空时可以用带字母的式子表示。)
(1)该混合物中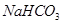 与
与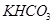 的质量分别为 和 。
的质量分别为 和 。
(2)若碳酸氢盐与盐酸恰好完全反应,则盐酸的物质的量浓度为 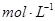 。
。
(3)如果盐酸过量,生成 的体积为 L。
的体积为 L。
(4)如果反应后碳酸氢盐有剩余,盐酸不足量,要计算生成 的体积,还需要知道 。
的体积,还需要知道 。
(5)若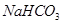 和
和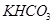 不是以等物质的量混合,则18.4 g固体混合物与足量的盐酸完全反应时生成
不是以等物质的量混合,则18.4 g固体混合物与足量的盐酸完全反应时生成 的物质的量(用n表示)的范围是
。
的物质的量(用n表示)的范围是
。
(12分,每空2分)(1)8.4 g 10 g (2)2 (3)4.48
(4)盐酸的物质的量浓度(或其他合理答案) (5)0.184<n<0.219
【解析】(1)设二者的物质的量都是x,则84x+100x=18.400,解得x=0.1mol,所以混合物中 与
与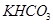 的质量分别为8.4g和10.0g。
的质量分别为8.4g和10.0g。
(2)碳酸氢盐与盐酸的方程式为H++HCO3-=H2O+CO2↑,所以消耗的盐酸是0.2mol,浓度是2.0mol/L。
(3)根据碳原子守恒可知,生成的CO2是0.2mol,标准状况下的体积是4.48L。
(4)如果盐酸不足,则要计算生成的CO2体积,还需要知道盐酸的浓度。
(5)可以采用极值法。如果全部是碳酸氢钠,则生成CO2是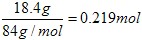 ;如果全部是碳酸氢钾,则生成CO2是18.4÷100=0.184mol,即CO2的范围是0.184<n<0.219。
;如果全部是碳酸氢钾,则生成CO2是18.4÷100=0.184mol,即CO2的范围是0.184<n<0.219。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
(12分)某研究性小组进行如下实验:常温下,将某一元酸HA和NaOH溶液等体积混合,两种溶液的浓度和混合后所得溶液的pH如下表:
| 实验编号 | HA物质的量浓度(mol/L) | NaOH物质的量浓度(mol/L) | 混合溶液的pH |
| ① | 0.1 | 0.1 | pH=9 |
| ② | c | 0.2 | pH=7 |
| ③ | 0.2 | 0.1 | pH<7 |
请回答:
(1)从①组情况分析,HA是强酸还是弱酸?__________(填“强酸”或“弱酸”)。
(2)②组情况表明,c____ 0.2mol/L(填﹥、﹤或=)。混合液中离子浓度c(A-) c(Na+)(填﹥、﹤或=)。
(3)从③组实验结果分析,说明HA的电离程度______NaA的水解程度 (填﹥、﹤或=),该混合溶液中离子浓度由大到小的顺序是_____ ___。
(4)①组实验所得混合溶液中由水电离出的c(OH-)=____________mol·L-1。
查看答案和解析>>
科目:高中化学 来源:2012-2013学年河南省西华一高高三上学期第一次月考化学试卷(带解析) 题型:计算题
.(12分)由等物质的量的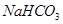 和
和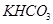 组成的混合物18.400 g,与100 mL盐酸反应。(题中涉及的气体体积均为标准状况下,填空时可以用带字母的式子表示。)
组成的混合物18.400 g,与100 mL盐酸反应。(题中涉及的气体体积均为标准状况下,填空时可以用带字母的式子表示。)
(1)该混合物中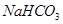 与
与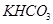 的质量分别为 和 。
的质量分别为 和 。
(2)若碳酸氢盐与盐酸恰好完全反应,则盐酸的物质的量浓度为  。
。
(3)如果盐酸过量,生成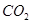 的体积为 L。
的体积为 L。
(4)如果反应后碳酸氢盐有剩余,盐酸不足量,要计算生成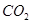 的体积,还需要知道 。
的体积,还需要知道 。
(5)若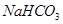 和
和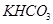 不是以等物质的量混合,则18.4 g固体混合物与足量的盐酸完全反应时生成
不是以等物质的量混合,则18.4 g固体混合物与足量的盐酸完全反应时生成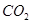 的物质的量(用n表示)的范围是 。
的物质的量(用n表示)的范围是 。
查看答案和解析>>
科目:高中化学 来源:2011-2012学年河北省石家庄市高三第二次模拟理科综合化学试卷(解析版) 题型:填空题
(14分)甲、乙、丙均为可溶于水的固体,可能含有的离子如下表所示:

已知:
①甲、乙的水溶液均呈碱性,丙的水溶液呈酸性;
②取一定量甲、乙、丙固体混合物,加足量水溶解,最终得到无色澄清溶液;
③向②中所得溶液逐滴加人盐酸至过量,开始无沉淀,后有沉淀生成,继续滴加沉淀消 失,过程中有无色无味气体逸出;
④向丙溶液中滴加BaCl2溶液,有白色沉淀生成;
⑤将甲溶液与丙溶液混合,生成白色沉淀和无色气体。
(1) 甲、乙、丙的化学式分别为____________
(2) 250C时,PH均为12的甲溶液和乙溶液中,由水电离出来的c(OH-)之比为______。
(3) 写出⑤中发生反应的离子方程式____________
(4) 250C时,将a mol/L CH3COOH溶液与0.02 mol/L乙溶液等体积混合,所得溶液呈中 性,则混合溶液中c(CH3COO-)=______ (忽略混合时溶液体积的变化)。
(5) 等物质的量浓度的乙溶液和丙溶液混合充分反应后,沉淀中的金属元素与溶液中该
元素的质量相等,则乙溶液和丙溶液的体枳比可能为______ (填选项字母)。
A. 3:1 B. 1:3 C. 7:1 D. 1:7
查看答案和解析>>
科目:高中化学 来源: 题型:
(04年全国卷)(l6分) 粉末状试样A是由等物质的量的MgO和Fe2O3组成的混合物。进行如下实验:
①取适量A进行铝热反应,产物中有单质B生成;
②另取20 g A全部溶于0.15 L 6.0 mol?![]() 盐酸中,得溶液C;
盐酸中,得溶液C;
③将①中得到的单质B和溶液C反应,放出 l.12 L(标况)气体,同时生成溶液D,还残留有固体物质B;
④用KSCN溶液检验时,溶液D不变色。
请填空:
(1)①中引发铝热反应的实验操作是_____。产物中的单质B是__________________。
(2)②中所发生的各反应的化学方程式是_______________。
(3)③中所发生的各反应的离子方程式是________________。
(4)若溶D的体积仍视为0.15 L,则该溶液中c(Mg2+)为_____________________________,
c(Fe2+)为____________________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com