
【题目】下列事实中,能说明氯的非金属性比硫强的是
A. 高氯酸的酸性比亚硫酸强 B. 次氯酸的氧化性比稀硫酸强
C. 氯化氢比硫化氢的热稳定性好 D. 氯原子最外层电子数比硫原子多
科目:高中化学 来源: 题型:
【题目】海水是巨大的资源宝库,从海水中提取食盐和溴的过程如下:
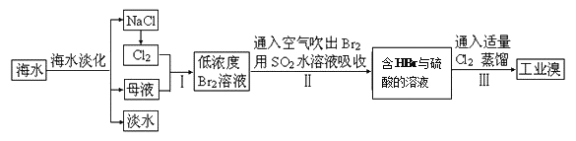
(1)除去粗盐中杂质(Mg2+、SO42-、Ca2+),加入的药品顺序正确的是__________。
A.NaOH溶液→Na2CO3溶液→BaCl2溶液→过滤后加盐酸
B.BaCl2溶液→NaOH溶液→Na2CO3溶液→过滤后加盐酸
C.NaOH溶液→BaCl2溶液→Na2CO3溶液→过滤后加盐酸
D.Na2CO3溶液→NaOH溶液→BaCl2溶液→过滤后加盐酸
(2)制备钠单质的方法之一是将熔融NaCl进行电解,写出电解化学方程式:
______________________________________________________。
(3)步骤Ⅰ中已获得Br2,步骤Ⅱ中又将Br2还原为Br-,其目的是____________。写出步骤Ⅱ中发生反应的化学方程式:_______________________________________________。
(4)某化学小组的同学为了了解从工业溴中提纯溴的方法,查阅了有关资料,Br2的沸点为59 ℃。微溶于水,有毒性和强腐蚀性。他们参观生产过程后,设计了如下实验装置:
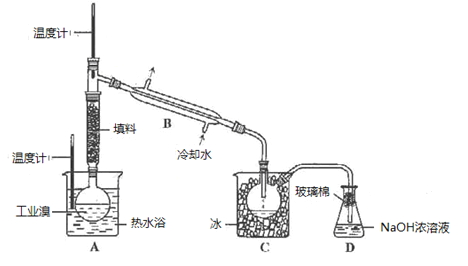
①图中仪器B的名称是________,冷却水的出口为____(填“甲”或“乙”)。
②C中液体的颜色为__________________。
③D装置的作用是__________________。
(5)已知某溶液中Cl-、Br-、I-的物质的量之比为2∶3∶4,现欲使溶液中的Cl-、Br-、I-的物质的量之比变成4∶3∶2,那么要通入Cl2的物质的量是原溶液中I-的物质的量的________。(填选项)
A.![]() B. C.
B. C.![]() D.
D.![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】增强铝的耐腐蚀性,现以铅蓄电池以外电源,以Al作阳极、Pb作阴极,电解稀硫酸,使表面表面的氧化膜增厚。反应原理如下:电池:Pb(s)+PbO2(s)+2H2SO4(aq)═2PbSO4(s)+2H2O(I)
电解池:2Al+3H2O![]() Al2O3+3H2↑
Al2O3+3H2↑
电解过程中,以下判断正确的是
电池 | 电解池 | |
A | H+移向Pb电极 | H+移向Pb电极 |
B | 每消耗3molPb | 生成2molAl2O3 |
C | 正极:PbO2+4H++2e-═Pb2++2H2O | 阳极:2Al+3H2O-6e-═Al2O3+6H+ |
D |
|
|
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2 mol A与2 mol B混合于2 L的密闭容器中,发生如下反应:2A(g)+3B(g)![]() 2C(g)+zD(g),2 s后A的转化率为50%,测得υ(D)=0.25 mol·L﹣1·s﹣1,下列推断不正确的是( )
2C(g)+zD(g),2 s后A的转化率为50%,测得υ(D)=0.25 mol·L﹣1·s﹣1,下列推断不正确的是( )
A. z=2 B. 2 s后,容器内的压强是初始的7/8倍
C. 2 s后,B的浓度为0.5 mol/L D. 2 s时C的体积分数为2/7
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以废旧铅酸电池中的含铅废料(Pb、PbO、PbO2、PbSO4及炭黑等)为原料,制备粗铅,实现铅的再生利用。其工作流程如下图所示:

已知:Ksp(PbSO4)=1.6×10-5,Ksp(PbCO3)=3.3×10-14.
(1)过程Ⅰ中,在Fe2+催化下,Pb和PbO2反应生成PbSO4的化学方程式是__________。
(2)过程Ⅰ中,Fe2+催化过程可表示为:
i:2Fe2++ PbO2+4H++SO42-![]() 2Fe3++PbSO4+2H2O
2Fe3++PbSO4+2H2O
ii: ……
①写出ii的离子方程式:________________。
②下列实验方案可证实上述催化过程。将实验方案补充完整。
a.向酸化的FeSO4溶液中加入KSCN溶液,溶液几乎无色,再加入少量PbO2,溶液变红。
b.___________。
(3)过程Ⅱ的目的是脱硫。若滤液2中c(SO42-)=1.6mol/L,c(CO32-)=0.1mol/L,则PbCO3中____(填“是”或“否”)混有PbSO4。
(4)钠离子交换膜固相电解法是从含铅废料中提取铅的一种新工艺,其装置如图所示。将含铅废料投入阴极室,含铅废料中的PbSO4与NaOH溶液发 生反应:PbSO4 + 3OH- = HPbO2-+ SO42- +H2O。

①a与外接电源的________极相连。
②电解过程中,PbO2、PbO、HPbO2-在阴极放电,其中PbO2放电的电极反应式为___________。
③与传统无膜固相电解法相比,使用钠离子交换膜可以 提高Pb元素的利用率,原因是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质分类正确的是
碱性氧化物 | 酸 | 盐 | |
A | CO2 | HCl | Na2CO3 |
B | CaO | NaHSO4 | KNO3 |
C | Al2O3 | HNO3 | CuSO4 |
D | MgO | H2SO4 | ZnCl2 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质按只有氧化性、只有还原性、既有氧化性又有还原性的顺序排列的是
A.O2、K、Cl2 B.Cl2、Al、H2
C.NO2、SO2、H2O D.HNO3、HCl、Fe2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】浓度均为0.10mol/L、体积均为V0的MOH和ROH溶液,分别加水稀释至体积V,pH随![]() 的变化如图所示,下列叙述错误的是( )
的变化如图所示,下列叙述错误的是( )

A.MOH的碱性强于ROH的碱性
B.ROH的电离程度:b点大于a点
C.若两溶液无限稀释,则它们的c(OH-)相等
D.当![]() =2时,若两溶液同时升高温度,则
=2时,若两溶液同时升高温度,则 ![]() 增大
增大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com