
| 实验编号 | 温度(K) | 盐酸浓度(mol?L-1) | 醋酸浓度(mol?L-1) | 实验目的 |
| ① | 298 | 0.20 | a.实验①和②是探究 不同温度 不同温度 对镁与盐酸反应速率的影响;b.实验①和③是探究 不同浓度 不同浓度 对镁与盐酸反应速率的影响;c.实验①和④是探究相同温度下,相同浓度的盐酸、醋酸与镁反应速率的区别. | |
| ② | 308 | 0.20 | ||
| ③ | 298 | 0.40 | ||
| ④ | 298 298 |
0.20 0.20 |
| 1 |
| 2 |
| K(CH3COOH).C(CH3COOH) |
| 1 |
| 2 |
| 1 |
| 2 |
 ;
; ;
;| K(CH3COOH).C(CH3COOH) |
| 1.0×10-5×0.10 |


科目:高中化学 来源:2012-2013学年广东省深圳高级中学高二(上)期中化学试卷(解析版) 题型:解答题
| 实验编号 | 温度(K) | 盐酸浓度 | 醋酸浓度 | 实验目的 |
| ① | 298 | 0.20 | a.实验①和②是探究______对镁与盐酸反应速率的影响; b.实验①和③是探究______对镁与盐酸反应速率的影响; c.实验①和④是探究相同温度下,相同浓度的盐酸、醋酸与镁反应速率的区别. | |
| ② | 308 | 0.20 | ||
| ③ | 298 | 0.40 | ||
| ④ | ______ | ______ |
查看答案和解析>>
科目:高中化学 来源: 题型:
(10分)![]() 同学们为了探究镁条与盐酸、醋酸反应时浓度或温度对反应速率(观察镁条消失的时间)的影响,他们准备了以下化学用品:0.20mol/L与0.40mol/L的HCl溶液、0.2mol/L与0.40mol/L的CH3COOH溶液、4条镁条(形状、大小、质量相同)、几支试管和胶头滴管,酸液温度控制为298K或308K。
同学们为了探究镁条与盐酸、醋酸反应时浓度或温度对反应速率(观察镁条消失的时间)的影响,他们准备了以下化学用品:0.20mol/L与0.40mol/L的HCl溶液、0.2mol/L与0.40mol/L的CH3COOH溶液、4条镁条(形状、大小、质量相同)、几支试管和胶头滴管,酸液温度控制为298K或308K。
(1)该实验缺少的仪器是 。
(2)酸液都取足量、相同体积,请你帮助完成以下面实验设计表:
实验
| 温度(K) | 盐酸浓度
| 醋酸浓度(mol?L-1) | 实验目的 |
① | 298 | 0.20 |
| a.实验①和②是探究 对镁与盐酸反应速率的影响;
|
② | 308 | 0.20 |
| |
③ | 298 | 0.40 |
| |
④ |
| 0.20 |
|
(3)预测:相同温度、相同浓度时,刚开始时两者产气的速率盐酸 醋酸(“填:=、>、<”),镁条最先消失的是 ;如果镁条足量时,选pH相同、等体积的盐酸和醋酸,产气最多的是 。
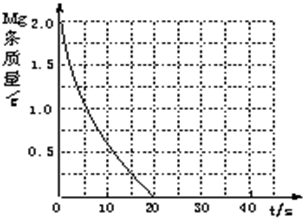
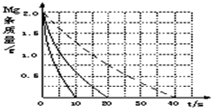
(4)若(2)中实验①镁条消失的时间是20s,则镁条剩余质量与时间关系图如右图。假设:该反应温度每升高10℃,反应速率是原来的2倍;温度相同时,醋酸是相同浓度盐酸平均速度的1/2,请你在此图中大致画出“实验②”(用实线)、“实验④中醋酸实验”(用虚线)的镁条质量与时间关系曲线。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com