
【题目】一定温度下,向容积为2L的密闭容器中通入两种气体发生化学反应,反应中各物质的物质的量变化如图所示,对该反应的推断合理的是

A.该反应的化学方程式为3B+2D 6A+4C
B.反应进行到1 s时,v(A)=3v(D)
C.反应进行到6 s时,B的平均反应速率为0.1mol/(Ls)
D.反应进行到6 s时,各物质的反应速率相等
【答案】B
【解析】
试题分析:A.由图可知,反应达到平衡时A物质增加了1.2mol、D物质增加了0.4mol、B物质减少了0.6mol、C物质减小了0.8mol,所以A、D为生成物,物质的量之比为3:1,B、C为反应物,物质的量之比为3:4,反应方程式为:3B+4C![]() 6A+2D,A错误;B.反应速率之比是化学计量数之比,所以v(A)=3v(D),B正确;C.反应进行到6s时,v(B)=△c÷△t=0.6mol÷(2L×6s)=0.05mol/(Ls),C错误;D.反应进行到6s时,v(A)=△c÷△t=1.2mol÷(2L×6s)=0.1mol/(Ls),v(B)=△c÷△t=0.6mol÷(2L×6s)=0.05mol/(Ls),v(C)=△c÷△t=0.8mol÷(2L×6s)=0.067mol/(Ls),v(D)=△c÷△t=0.4mol÷(2L×6s)=0.033mol/(Ls)所以反应进行到6s时,各物质的反应速率不相等,D错误。答案选B。
6A+2D,A错误;B.反应速率之比是化学计量数之比,所以v(A)=3v(D),B正确;C.反应进行到6s时,v(B)=△c÷△t=0.6mol÷(2L×6s)=0.05mol/(Ls),C错误;D.反应进行到6s时,v(A)=△c÷△t=1.2mol÷(2L×6s)=0.1mol/(Ls),v(B)=△c÷△t=0.6mol÷(2L×6s)=0.05mol/(Ls),v(C)=△c÷△t=0.8mol÷(2L×6s)=0.067mol/(Ls),v(D)=△c÷△t=0.4mol÷(2L×6s)=0.033mol/(Ls)所以反应进行到6s时,各物质的反应速率不相等,D错误。答案选B。


科目:高中化学 来源: 题型:
【题目】下图表示氮及其化合物在一定条件下的转化关系:

(1)反应I:N2(g)+3H2(g)![]() 2NH3(g) ΔH=–92 kJmol-1
2NH3(g) ΔH=–92 kJmol-1
下左图是反应I中平衡混合气中NH3的体积分数随温度或压强变化的曲线,图中L(L1、L2)、X分别代表温度或压强。其中X代表的是________(填“温度”或“压强”)。

(2)①反应II的化学方程式是_________________________。
②反应II其中一步反应为2NH3(g)+3Cl2(g) =N2(g) +6HCl(g) ΔH=–462 kJmol-1
已知:N2(g)![]() 2N(g) Cl2(g)
2N(g) Cl2(g)![]() 2Cl(g)
2Cl(g)
断开1 mol H–N键与断开1 mol H–Cl键所需能量相差约为________kJ。
(3)(3)反应III是利用右上图所示装置电解制备NCl3(氯的化合价为+1),其原理是:NH4Cl+2HCl![]() NCl3+3H2↑。
NCl3+3H2↑。
①b接电源的_______极(填“正”或“负”)。② 阳极反应式是___________________。
(4)反应III得到的NCl3可以和NaClO2制备 ClO2,同时生成NH3,该反应的离子方程式是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用已知浓度的NaOH溶液测定某H2SO4溶液的浓度,参考如图所示从下表中选出正确选项( )
选项 | 锥形瓶中溶液 | 滴定管中溶液 | 选用指示剂 | 选用滴定管 |
A | 碱 | 酸 | 石蕊 | 乙 |
B | 酸 | 碱 | 酚酞 | 甲 |
C | 碱 | 酸 | 甲基橙 | 乙 |
D | 酸 | 碱 | 酚酞 | 乙 |
![]()
A.A
B.B
C.C
D.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】砷(As)是第四周期ⅤA族元素,可以形成As2O3、As2O5、H3AsO3、H3AsO4等化合物,有着广泛的用途。回答下列问题:
(1)画出砷的原子结构示意图____________。
(2)工业上常将含砷废渣(主要成分为As2S3)制成浆状,通入O2氧化,生成H3AsO4和单质硫。写出发生反应的化学方程式________。该反应需要在加压下进行,原因是________。
(3)已知:As(s)+![]() H2(g)+2O2(g)=H3AsO4(s) ΔH1
H2(g)+2O2(g)=H3AsO4(s) ΔH1
H2(g)+![]() O2(g)=H2O(l) ΔH2
O2(g)=H2O(l) ΔH2
2As(s)+![]() O2(g) =As2O5(s) ΔH3
O2(g) =As2O5(s) ΔH3
则反应As2O5(s) +3H2O(l)= 2H3AsO4(s)的ΔH =_________。
(4)298 K时,将20 mL 3x mol·L1 Na3AsO3、20 mL 3x mol·L1 I2和20 mL NaOH溶液混合,发生反应:AsO33(aq)+I2(aq)+2OH![]() AsO43(aq)+2I(aq)+ H2O(l)。溶液中c(AsO43)与反应时间(t)的关系如图所示。
AsO43(aq)+2I(aq)+ H2O(l)。溶液中c(AsO43)与反应时间(t)的关系如图所示。

①下列可判断反应达到平衡的是__________(填标号)。
a.溶液的pH不再变化
b.v(I)=2v(AsO33)
c. c (AsO43)/c (AsO33)不再变化
d. c(I)=y mol·L1
②tm时,v正_____ v逆(填“大于”“小于”或“等于”)。
③tm时v逆_____ tn时v逆(填“大于”“小于”或“等于”),理由是_____________。
④若平衡时溶液的pH=14,则该反应的平衡常数K为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,在密闭容器中SO2、O2、SO3三种气态物质建立化学平衡后,改变条件对反应2SO2(g)+O2(g)2SO3(g),△H<0的正、逆反应速率的影响如图所示: 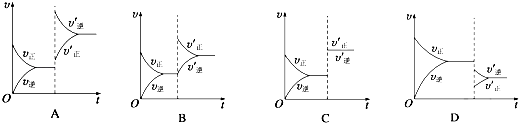
(1)加催化剂对反应速率影响的图像是(填序号,下同),平衡移动.
(2)升高温度对反应速率影响的图像是 , 平衡向方向移动.
(3)增大反应容器体积对反应速率影响的图像是 , 平衡向方向移动.
(4)增大O2的浓度对反应速率影响的图像是 , 平衡向方向移动.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分析以下几个热化学方程式,哪个是表示固态碳和气态氢气燃烧时的燃烧热的是( )
A.C(s)+O2(g)═CO(g)△H=﹣110.5 kJ/mol
B.C(s)+O2(g)═CO2(g)△H=﹣393.5 kJ/mol
C.2H2(g)+O2(g)═2H2O(l)△H=﹣571.6 kJ/mol
D.H2(g)+ ![]() ?O2(g)═H2O(g)△H=﹣241.8 kJ/mol
?O2(g)═H2O(g)△H=﹣241.8 kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫代硫酸钠(Na2S2O3)是环保部门监测有害气体常用的一种药品,它易溶于水,遇酸易分解。某实验室模拟工业硫化碱法制取硫代硫酸钠,其反应装置及所需试剂如图。

实验具体操作步骤为:
①打开分液漏斗使硫酸慢慢滴下,适当调节分液漏斗的滴速,使反应产生的SO2气体较均匀的通入Na2S和Na2CO3的混合溶液中,同时开启电动搅拌器搅动,水浴加热,微沸。
②直至析出的浑浊不再消失,并控制溶液的pH接近7时,停止通入SO2气体。
(1)写出仪器A的名称____。
(2)写出A中发生反应的化学方程式____。
(3)为了保证硫代硫酸钠的产量,实验中通入的SO2不能过量,原因是____。
(4)Na2S2O3常用作脱氯剂,在溶液中易被Cl2氧化成SO42离子,该反应的离子方程式为____。
(5) 为了验证固体硫代硫酸钠工业产品中含有碳酸钠,选用下图装置进行实验。
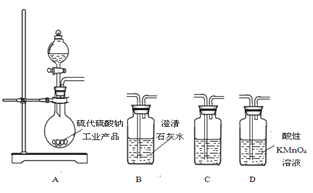
①实验装置的连接顺序依次是____(填装置的字母代号),装置C中的试剂为____。
②能证明固体中含有碳酸钠的实验现象是____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com