
碘是重要的无机化工原料,海藻灰化法是我国目前制碘的主要方法。某研究性学习小组查阅文献,设计并进行了以下模拟实验。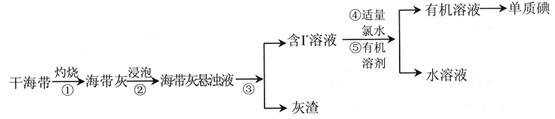
请回答:
(1)步骤①中灼烧海带用到的实验仪器是______________________(填序号)。
a. 试管 b. 坩埚 c. 烧杯
(2)步骤③的实验操作是_______________________。
(3)步骤④中反应的离子方程式是_____________________________________。
(4)步骤⑤中,可以选择的有机溶剂是__________________(填序号)。
a. 乙酸 b. 四氯化碳 c. 酒精 d. 苯
(5)同学们观察到完成步骤⑤后,所得到的水溶液呈淡黄色。某同学推断其中可能含有碘单质,检验方法是: __________________________________________________________________________。
(6)因过量的Cl2会与I2反应,所以步骤④中加入的氯水应保持适量。为证明此说法,某同学做如下实验:取少量碘水,滴加氯水,观察到碘水逐渐褪色,经检验生成物含有IO3-。该反应的化学方程式是_________________________________。
(9分)(1)b(1分)(2)过滤(1分) (3)Cl2+2I-=2Cl-+I2(2分)
(4)bd(1分,错选为0分,少选为0.5分)
(5)取少量溶液于试管中,滴入几滴淀粉溶液,若溶液呈蓝色,证明溶液中还含有I2。
(2分,取样、试剂、现象、结论各0.5分,若试剂错为0分)
(6)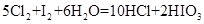 (2分)
(2分)
解析试题分析:(1)固体灼烧需要在坩埚中进行,所以步骤①中灼烧海带用到的实验仪器是坩埚,答案选b。
(2)步骤③的的目的是分离出灰渣和含有碘离子碘溶液,所以实验操作是过滤。
(3)氯水具有强氧化性,能把碘离子氧化生成单质碘,反应的离子方程式是Cl2+2I-=2Cl-+I2。
(4)步骤⑤是萃取,萃取适合于溶质在不同溶剂中的溶解性不同而分离的一种方法,选用的萃取剂的原则是:①和原溶液中的溶剂互不相溶更不能发生化学反应;②溶质在该溶剂中溶解度要远大于原溶剂。乙酸和乙醇都是与水互溶的,所以可以选择的有机溶剂是苯和四氯化碳,答案选bd。
(5)因为单质碘能和淀粉发生显色反应,而使显蓝色,据此可以鉴别。即取少量溶液于试管中,滴入几滴淀粉溶液,若溶液呈蓝色,证明溶液中还含有I2。
(6)经检验生成物含有IO3-,即单质碘被氧化生成了IO3-,而还原产物是氯化氢,所以反应的离子方程式是5Cl2+I2+6H2O=2HIO3+10HCl。
考点:考查从海水中提取单质碘的有关判断
点评:该题是高考中的常见题型,属于中等难度的试题。试题易碘的提取为载体,涉及仪器的选择、物质的分离和提纯、方程式的书写、萃取剂的选择以及单质碘的检验,有利于激发学生的学习兴趣,增强学生的学习积极性。


科目:高中化学 来源: 题型:实验题
达州市渠县境内含有丰富的深层地下食盐资源,食盐是日常生活中的必需品,也是重要的化工原料。
(1)经测定该县深层地下粗盐中含有少量K+、Ca2+、Mg2+、Fe3+等杂质离子,某研究性学习小组在实验室提纯NaCl的流程如下:
所提供的试剂:饱和Na2CO3溶液、饱和K2CO3溶液、NaOH溶液、BaCl2溶液、Ba(NO3)2溶液、75%乙醇溶液、CCl4,仪器及用品自选。
①欲除去溶液中的Ca2+、Mg2+、Fe3+、SO42-,选出a操作中所代表的试剂,按滴加顺序依次为
(只填化学式),b步操作的名称是 。
②洗涤除去NaCl晶体表面附带的少量KCl,应选用试剂是 ,用PH试纸测定滤液ⅡPH值的方法是 。
(2)用提纯的NaCl配制500mL,2.5mol·L-1的NaCl溶液,所需仪器除烧杯,托盘天平(砝码和镊子),药匙,玻璃棒外,还需要 (填仪器名称),应称取NaCl g
(3)下列操作会导致所配NaCl溶液浓度偏高的是
| A.定容完毕后,盖塞,摇匀,再将容量瓶置于实验台上,发现液面低于刻度线,再添加蒸馏水至刻度线。 | |
| B.未将洗涤烧杯内壁的溶液转入容量瓶。 | C.定容时,俯视刻度线。 |
| D.转移溶液之前,容量瓶内有少量蒸馏水。 E、称量时,天平指针指向左盘。 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
草酸亚铁(FeC2O4?2H2O)用作分析试剂及显影剂和新型电池材料磷酸亚铁锂的生产。已知:CO能与氯化钯(PdCl2)溶液反应生成黑色的钯粉。回答下列问题:
I.兴趣小组对草酸亚铁的分解产物进行实验和探究。
(1)将气体产物依次通过A、澄清石灰水,B、氯化钯,观察到A中澄清石灰水都变浑浊,B中出现黑色物质生成,则上述现象说明气体产物中有 。
(2)探究分解得到的固体产物中铁元素的存在形式。
①提出假设
假设1:________; 假设2:FeO; 假设3:FeO和Fe混合物
②设计实验方案证明假设3。
限选试剂: 1.0 mol?L-1盐酸、3% H2O2、0.1 mol?L-1CuSO4、20% KSCN、蒸馏水。
| 实验步骤 | 现象与结论 |
| 步骤1 :向试管中加入少量固体产物,再加入足量_________________,充分振荡 | 若溶液颜色明显改变,且有_______生成,则证明有铁单质存在 |
| 步骤2: 将步骤1中得到的浊液过滤,并用蒸馏水洗涤至洗涤液无色 | |
| 步骤3:取步骤2得到的少量固体与试管中, 滴加___________________________________ _______________________________________ | __________________________________ ___________________________________ |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
某矿样含有大量的CuS、少量铁的氧化物及少量其它不溶于酸的杂质。某化学课外小组设计以下流程,取该矿样为原料生产CuC12·2H2O晶体。
已知:常温下,金属离子开始沉淀和沉淀完全时的pH见下表。
| 金属离子 | 氢氧化物开始沉淀的pH | 氢氧化物沉淀完全的pH |
| Fe2+ | 7.0 | 9.0 |
| Fe3+ | 1.9 | 3.2 |
| Cu2+ | 4.7 | 6.7 |

查看答案和解析>>
科目:高中化学 来源: 题型:实验题
实验室制备肉桂酸的化学方程式为:
副反应:
药品物理常数
主要实验装置和步骤如下:
(I) 合成:
向装置1的三颈烧瓶中先后加入3g新熔融并研细的无水醋酸钠、3mL新蒸馏过的苯甲醛和 5.5mL乙酸酐,振荡使之混合均匀。在150~170℃加热回流40min,反应过程中体系的颜色会逐 渐加深,并伴有棕红色树脂物出现。
(II)分离与提纯:
①向反应液中加30mL沸水,加固体碳酸钠至反应混合物呈弱碱性。
②按装置2进行水蒸气蒸馏,在冷凝管中出现有机物和水的混合物,直到馏出液无油珠。
③剩余反应液体中加入少许活性炭,加热煮沸,趁热过滤,得无色透明液体。
④滤液用浓盐酸酸化、冷水浴冷却、结晶、抽滤、洗涤、重结晶,得肉桂酸无色晶体。 回答下列问题:
(1)合成过程中要求无水操作,理由是______。将含结晶水的醋酸钠加热制无水醋酸钠,观察到盐由固体→液体→固体→液体。第一次变成液体的原因是_____。
(2)合成过程的加热回流,要控制皮应呈微沸状态,如果剧烈沸腾,可能导致()
A.使肉桂酸蒸出影响产率
B.使乙酸酐蒸出影响产率
C.肉桂酸脱羧成苯乙烯,进而生成苯乙烯低聚物,甚至生成树脂状物
D.反应变缓慢
(3)仪器A的名称_____:玻璃管B的作用_____。
(4)分离和提纯操作中,步骤①加Na2CO3目的是_____。
(5)水蒸气蒸馏就是将水蒸气通入不溶或难溶于水但有一定挥发性的有机物中,使该有机物在 ,低于1000C的温度下,与水共沸而随着水蒸气一起蒸馏出来。步骤②的目的____,蒸馏结束后先____,再____,以防倒吸。
(6)步骤③加活性炭目的是____:若趁热过滤在抽滤装置中进行,下列操作错误的是()
A.布氏漏斗和滤纸要事先用沸水预热
B.各步操作的动作一定要快
C.为防止滤纸破损,混和液必须用玻璃棒引流至布氏漏斗
D.吸滤瓶内的溶液可直接从支管口倒出
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
实验室中某些气体的制取、收集、尾气处理(或性质实验)装置如图所示,用此装置和下表中提供的物质完成相关实验,合理的选项是
| 选项 | I中的物质 | II中收集的气体 | III中的物质 |
| A | Cu和浓硝酸 | NO | NaOH溶液 |
| B | 浓盐酸和MnO2 | Cl2 | NaOH溶液 |
| C | 碳酸钙和盐酸 | CO2 | 澄清石灰水 |
| D | 浓氨水和CaO | NH3 | 酚酞溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列关于除去物质中杂质的方案设计,所选除杂试剂合理的是( )
| | 主要物质 | 杂质 | 除杂试剂 |
| A | SiO2 | Al2O3 | 盐酸 |
| B | Si | C | 氧气 |
| C | CO2 | SO2 | Na2CO3溶液 |
| D | Cl2 | HCl | NaOH溶液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com