
| A. | 2HA+C3-═2A-+H2C- | B. | H3C+3A-═3HA+C3- | ||
| C. | H3C+B2-═HB-+H2C- | D. | HB-+A-═HA+B2- |
分析 先根据题目中的信息,判断酸性顺序:第一步电离程度远大于第二步电离程度,第二步电离程度远大于第三步电离程度,得到H2B>HB-、H3C>H2C->HC2-,它们之间能发生下列反应,得到①HA+HC2-(少量)=A-+H2C-,即HA>H2C-,同时,即使HA过量,也只能生成H2C-,而不是H3C,说明HA<H3C,②H2B(少量)+2A-=2HA+B2-,即H2B>HA,同时,由于H2B很少,并生成B2-,即说明H2B将2个H+都给了A-,即HB-也能将H+给A-,即说明H2B>HB->HA,③H2B(少量)+H2C-=HB-+H3C,即H2B>H3C,但是生成HB-,即说明HB-不能将H+提供,即HB-<H3C,即H2B>H3C>HB-,综合得到:H2B>H3C>HB->HA>H2C->HC2-,然后根据强酸制取弱酸原理进行判断.
解答 解:第一步电离程度远大于第二步电离程度,第二步电离程度远大于第三步电离程度,得到H2B>HB-、H3C>H2C->HC2-,它们之间能发生下列反应,得到①HA+HC2-(少量)=A-+H2C-,即HA>H2C-,同时,即使HA过量,也只能生成H2C-,而不是H3C,说明HA<H3C,②H2B(少量)+2A-=2HA+B2-
即H2B>HA,同时,由于H2B很少,并生成B2-,即说明H2B将2个H+都给了A-,即HB-也能将H+给A-,即说明H2B>HB->HA,③H2B(少量)+H2C-=HB-+H3C,即H2B>H3C,但是生成HB-,即说明HB-不能将H+提供,即HB-<H3C,即H2B>H3C>HB-,综合得到:H2B>H3C>HB->HA>H2C->HC2-,
A.由于酸性HA>H2C-,所以反应2HA+C3-═2A-+H2C-能够发生,故A正确;
B.由于酸性HA>H2C-,则该反应生成的是H2C-,所以反应H3C+3A-═3HA+C3-不能发生,故B错误;
C.酸性HA>H2C-,则反应H3C+B2-═HB-+H2C-能够发生,故C正确;
D.酸性HB->HA,则反应HB-+A-═HA+B2-能够发生,故D正确;
故选B.
点评 本题考查了酸性强弱判断、离子方程式书写方法等知识,题目难度中等,正确判断酸性强弱为解答关键,注意掌握离子方程式的书写原则,试题培养了学生的分析能力及灵活应用能力.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该混合粉末从组成看,其成分皆是碱性氧化物 | |
| B. | 溶液Y 中2n(Mg2+)<n(Cl-)<3n(Fe3+) | |
| C. | 沉淀X的成分为二氧化硅 | |
| D. | 在溶液Y 中加入过量的氨水,过滤得到的沉淀的成分是氢氧化铁和氢氧化镁 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
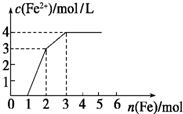 向含Fe(NO3)3、Cu(NO3)2、HNO3的稀溶液中逐渐加入铁粉,c(Fe2+)的变化如图所示.
向含Fe(NO3)3、Cu(NO3)2、HNO3的稀溶液中逐渐加入铁粉,c(Fe2+)的变化如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 已知:A、B、C、D、E、F、G七种元素的核电荷数依次增大,属于元素周期表中前四周期的元素.其中A原子在基态时p轨道半充满且电负性是同族元素中最大的;D、E原子核外的M层中均有两个未成对电子;G原子核外价电子数与B相同,其余各层均充满.B、E两元素组成化合物B2E的晶体为离子晶体.C、F的原子均有三个能层,C原子的第一至第四电离能(KJ•mol-1)分别为578、1 817、2 745、11 575;C与F能形成原子数目比为1:3、熔点为190℃的化合物Q.
已知:A、B、C、D、E、F、G七种元素的核电荷数依次增大,属于元素周期表中前四周期的元素.其中A原子在基态时p轨道半充满且电负性是同族元素中最大的;D、E原子核外的M层中均有两个未成对电子;G原子核外价电子数与B相同,其余各层均充满.B、E两元素组成化合物B2E的晶体为离子晶体.C、F的原子均有三个能层,C原子的第一至第四电离能(KJ•mol-1)分别为578、1 817、2 745、11 575;C与F能形成原子数目比为1:3、熔点为190℃的化合物Q.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Y的离子半径比X的离子半径大 | |
| B. | 化合物Y2Z中既有离子键、又有共价键 | |
| C. | Y、W最高价氧化物对应水化物的溶液均能溶解氧化铝 | |
| D. | 简单气态氢化物的稳定性由强到弱的顺序:Z、W、X |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C的生成速率与C的分解速率相等 | |
| B. | 单位时间内生成a mol A,同时生成3a mol B | |
| C. | A、B、C的浓度不再变化 | |
| D. | 混合气体的总压强不再变化 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com