
 的键线式是
的键线式是 的一氯取代物有
的一氯取代物有 中的碳氢符号省略可得其键线式,该有机物的键线式为:
中的碳氢符号省略可得其键线式,该有机物的键线式为: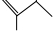 ,
, ;
; 分子中,周围3个苯环位置等效,每个苯环上含有2种等效氢原子,所以该有机物的一氯代物有2种,
分子中,周围3个苯环位置等效,每个苯环上含有2种等效氢原子,所以该有机物的一氯代物有2种,

科目:高中化学 来源: 题型:
| A、39K+和40Ca2+微粒中的电子数和中子数都相等 |
| B、在标准状况下,若D2和He体积相等,则质量不相等 |
| C、7.8g Na2O2与足量的CO2反应时失去的电子数为0.2 NA |
| D、把1mol NaCl溶于1L水中,所得NaCl溶液的物质的量浓度为1mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| 操 作 | 现 象 |
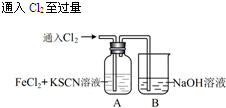 |
I.A中溶液变红 Ⅱ.稍后,溶液由红色变为黄色 |
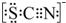 .
.查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| H2SO4 |
| NaOH |
| NaOH |
| H2SO4 |
|
| A、甲、乙消耗的原料同样多 |
| B、乙消耗的原料最少 |
| C、三者消耗的原料同样多 |
| D、丙消耗的原料最少 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com