
【题目】能证明次氯酸是一种弱酸的事实是( )
A.次氯酸不稳定,易分解
B.次氯酸钙可与CO2和H2O反应
C.次氯酸是一种强氧化剂
D.次氯酸能漂白有色纸张
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】水中因含有机物而具有较高的化学耗氧量.常用酸性KMnO4氧化有机物测其含量.主要操作步骤如下: 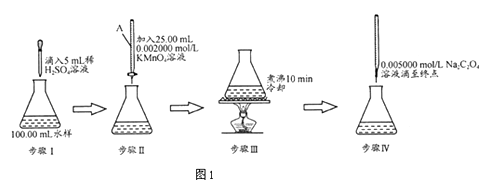
(1)仪器A为(填酸式或碱式)滴定管;要顺利完成实验,步骤Ⅲ中溶液颜色应为;
(2)完善步骤Ⅳ涉及的离子方程式:
C2O42﹣+MnO4﹣+H+═Mn2++CO2↑+;
该步骤中滴入第一滴Na2C2O4时褪色较慢,以后的滴定中褪色较快,其原因是
(3)若步骤Ⅳ中所用Na2C2O4溶液为20.00mL,已知滴定后的液面如图所示,请在图2中标出滴定前的液面. 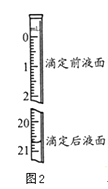
(4)若实验测量结果比实际有机物含量偏高,分别从以下两个方面猜想:
猜想1:水样中Cl﹣影响
猜想2:配制Na2C2O4标液定容时;
(5)若猜想1成立,请根据资料卡片补充完善上述实验以消除Cl﹣影响.(限选试剂:AgNO3溶液、Ag2SO4溶液、KMnO4溶液、Na2C2O4溶液) .
资料卡片:
①有机质可HNO3被氧化
②AgCl不与酸性KMnO4溶液反应
③Ag2C2O4可被酸性KMnO4溶液氧化.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NH2OH(羟胺)是一种无色针状结晶,羟胺及其盐类常用作有机合成的还原剂。回答下列问题:
(1) NH2OH的电子式为________________。
(2)拉西法制备羟胺的总反应为2NO2-+4SO2+6H2O+6NH3=4SO42-+6NH4++2NH2OH。该反应中NH3__________(填“作氧化剂”“作还原剂”或“既不作氧化剂又不作还原剂”)。
(3)室温时,NH2OH会发生分解反应,分解产生的无色气体遇浓盐酸产生白烟,与空气接触变为红棕色;且其分解产物会使无水CuSO4变蓝色,则NH2OH分解反应的化学方程式为______________________。
(4)催化还原NO是制备盐酸羟胺的一种方法,其反应原理如下:2NO+3H2+2HCl![]() 2NH2OH·HCl,某校合作学习小组的同学设计了如图所示装置制备盐酸羟胺:
2NH2OH·HCl,某校合作学习小组的同学设计了如图所示装置制备盐酸羟胺:

①该实验适宜的加热方式为______________。
②装置中导管X的作用是_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢化亚铜(CuH)是一种难溶物质,用CuSO4溶液和“另一物质”在40~50℃时反应可生成它.CuH不稳定,易分解;在氯气中能燃烧;与稀盐酸反应能生成气体;Cu+在酸性条件下发生反应是2Cu+═Cu2++Cu.
根据以上信息,结合自己所掌握的化学知识,回答下列问题:
(1)在CuSO4溶液和“另一物质”制CuH的反应中,用氧化还原观点分析,这“另一物质”在反应中所起的作用是(填“氧化剂”或“还原剂”).
(2)写出CuH在氯气中燃烧的化学反应方程式 .
(3)CuH溶液在稀盐酸中生成的气体是(填化学式).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E五种短周期元素,它们的原子序数依次增大;A元素的原子是半径最小的原子;B元素的最高价氧化物对应水化物与其氢化物反应生成一种盐X;D与A同主族,且与E同周期;E元素的最外层电子数是其次外层电子数的3/4倍,A、B、D、E这四种元素,每一种与C元素都能形成原子个数比不相同的若干种化合物.请回答下列问题:
(1)写出元素E在周期表中的位置:;判断物质X中存在的化学键类型 .
(2)C、D、E分别形成的简单离子半径由大到小的顺序是:(用离子符号表示);C、E氢化物的热稳定性比较(用具体物质化学式比较).
(3)B元素的氢化物可以在实验室中制取, 
①写出B元素氢化物的电子式,其实验室发生装置可以选择如图中的 , 常用的实验室制备反应的化学方程式为 .
②欲制备并收集一瓶干燥的该气体,选择如图中的装置,其连接顺序为:(按气流方向,用导管口字母表示) .
③欲证明上述盐X溶液中含有的阳离子,其方法是 .
(4)E的最高价态与A、B、C三种元素形成的酸式盐Y在水溶液中的电离方程式是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,对于反应:CaCO3(块状)+2HCl=CaCl2+CO2↑+H2O,为加快反应速率,下列方法可行的有( )
①增加盐酸的浓度 ②增加同浓度盐酸的用量 ③加水 ④增加CaCO3(块状)的用量 ⑤将块状CaCO3改为粉末状CaCO3
A.1项
B.2项
C.3项
D.4项
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图甲是利用一种微生物将废水中的尿素[CO(NH2)2]的化学能直接转化为电能,并生成环境友好物质的装置,同时利用此装置的电能在铁上镀铜。下列说法中正确的是

A. 铜电极应与X相连接
B. H+经过质子交换膜由右向左移动
C. 当N电极消耗0. 25 mol气体时,则铁电极增重16 g
D. M电极反应式:CO(NH2)2+H2O-6e- =CO2↑+N2↑+6H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】配制250 mL 0.10 mol·L-1的NaOH溶液时,下列实验操作会使配得的溶液浓度偏大的是
A. 溶解后溶液尚未冷却就转移至容量瓶中
B. 转移溶液后未洗涤烧杯和玻璃棒
C. 在容量瓶中定容时仰视刻度线
D. 倒转摇匀后,发现液面低于刻度,再补水至刻度线
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com