
水解反应是广泛存在的一类反应,盐的水解即为一例。越弱越水解是盐水解的重要规律,如NaCl不水解,MgCl2水解,而同浓度的AlCl3水解程度比MgCl2高。从同周期中元素金属性递变规律看H4SiO4的酸性更弱,因而SiCl4水解更完全。
(1)请写出下列化学方程式:
①SiCl4水解:
________________________________________________________________________;
②PCl5水解:
________________________________________________________________________。
(2)Mg3N2及CaC2与水反应也可看做水解,注意以下规律:
Mg3N2+6H2O===3Mg(OH)2↓+2NH3↑
CaC2+2H2O===Ca(OH)2+C2H2↑
写出下列化学方程式:
①Ca3P2与水反应:
________________________________________________________________________;
②Mg3C2与水反应:
________________________________________________________________________。
(1)①SiCl4+4H2O===4HCl+H4SiO4
②PCl5+4H2O===H3PO4+5HCl
(2)①Ca3P2+6H2O===3Ca(OH)2+2PH3↑
②Mg3C2+6H2O===3Mg(OH)2↓+C2H6↑
【解析】
试题分析:盐电离出的离子结合水电离出的氢离子或OH-离子生成弱电解质的反应是盐类水解,水解反应的规律:盐中的阳离子部分与水中的氢氧根离子结合,剩余的部分结合。酸根离子结合氢离子,据此规律,可写出水解反应的方程式。
考点:考查水解方程式的书写
点评:该题是中等难度的试题,也是高考中的常见考点。试题基础性强,主要是考查学生对盐类水解过量的熟悉了解程度,侧重对学生基础知识的巩固和训练,有利于培养学生的逻辑推理能力和规范的答题能力,提高学生的学习效率。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:022
水解反应是广泛存在的一类反应,盐的水解即为一例.越弱越水解是盐水解的重要规律,如NaCl不水解,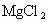 水解,而同浓度的
水解,而同浓度的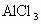 水解程度比
水解程度比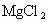 高.从同周期中元素金属性递变规律看
高.从同周期中元素金属性递变规律看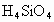 的酸性更弱,因而
的酸性更弱,因而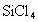 水解更完全.
水解更完全.
(1)请写出下列化学方程式:
①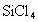 水解:_________________________;
水解:_________________________;
②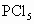 水解:__________________________.
水解:__________________________.
(2)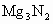 及
及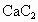 与水的反应也可看做水解,注意以下规律:
与水的反应也可看做水解,注意以下规律:
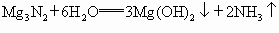
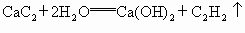
写出下列化学方程式:
①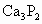 与水反应:_______________________;
与水反应:_______________________;
②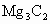 与水反应:_______________________.
与水反应:_______________________.
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)请写出下列化学方程式:
①SiCl4水解:_____________________________________________________;
②PCl5水解:______________________________________________________。
(2)Mg3N2及CaC2与水的反应也可看作水解,注意以下规律:
Mg3N2+6H2O![]() 3Mg(OH)2↓+2NH3↑
3Mg(OH)2↓+2NH3↑
CaC2+2H2O![]() Ca(OH)2+C2H2↑
Ca(OH)2+C2H2↑
写出下列化学方程式:
①Ca3P2与水反应:_________________________________________________;
②Mg
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com