
����Ŀ��ij�¶��£�HNO2��CH3COOH�ĵ��볣���ֱ�Ϊ5.0��10-4��1.7��10-5����pH��ͬ�������ΪV0����������Һ�ֱ��ˮϡ�������V��pH��![]() �ı仯��ͼ��ʾ�����������������
�ı仯��ͼ��ʾ�����������������
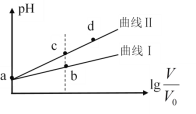
A.����������CH3COOH��Һ
B.��Һ��ˮ�ĵ���̶ȣ�b��С��c��
C.��ͬ���a���������ֱ���NaOH��Һǡ���кͺ���Һ��n(NO2��)��n(CH3COO��)
D.��c�㵽d�㣬��Һ��![]() ���ֲ��䣨����HA��A���ֱ������Ӧ�����������ӣ�
���ֲ��䣨����HA��A���ֱ������Ӧ�����������ӣ�
���𰸡�C
��������
�ɵ��볣����֪��HNO2��CH3COOH�������ᣬ���Ҵ�������Ը�����pH��ͬ�������ΪV0����������Һ�У���������ʵ������������
A. ��ͬpH�������ˮϡ�ͣ�����Խǿ���ᣬpH�仯Խ����������������CH3COOH��Һ����ȷ��
B.��ͼ�п��Կ�������Һ��pH b��С��c�㣬˵��c(H+)b���c���c(OH-) c���b��Ӷ�˵����Һ��ˮ�ĵ���̶�c���b�����ȷ��
C. ��ͬ���a��������ᣬ��������ʵ����ֱ���NaOH��Һǡ���кͺ���Һ��n(NO2��)<n(CH3COO��)������
D. ��c�㵽d�㣬����ĵ��볣����ˮ�ĵ��볣�������䣬����Kw/Ka���䣬��![]() ���ֲ��䣬��ȷ��
���ֲ��䣬��ȷ��
�ʴ�ΪC��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����3Cl2��6KOH![]() KClO3��5KCl��3H2O�ķ�Ӧ��������˵������ȷ���� (����)
KClO3��5KCl��3H2O�ķ�Ӧ��������˵������ȷ���� (����)
A. Cl2����������KOH�ǻ�ԭ��
B. KCl�ǻ�ԭ���KClO3����������
C. ��Ӧ��ÿ����3 mol Cl2��ת�Ƶ�����Ϊ5NA
D. ����ԭ�����������ʵ����DZ����������������ʵ�����5��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������й�˵����ȷ����
A. 298 Kʱ��2H2S(g)��SO2(g)===3S(s)��2H2O(l)���Է����У�������H��0
B. ��ˮϡ�ͺ���Һ��c(NH4��)/c(NH3��H2O)��ֵ��С
C. ��⾫��ͭ�����У����������ļ�������������������һ�����
D. 25��ʱKa(HClO)��3.0��108��Ka(HCN)��4.9��1010�������¶���NaClO��Һ��NaCN��Һ��pH��ͬ����c(NaClO)��c(NaCN)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���¶�ΪTʱ�������Ϊ2 L�ĺ����ܱ������м����������ۺ�0.08 mol H2O(g)��������Ӧ3Fe(s)��4H2O(g)![]() Fe3O4(s)��4H2(g)��һ��ʱ����ƽ�⡣t1ʱ�����������ٳ���һ������H2���ٴδ�ƽ��ʱH2���������Ϊ20%������˵����ȷ����(����)
Fe3O4(s)��4H2(g)��һ��ʱ����ƽ�⡣t1ʱ�����������ٳ���һ������H2���ٴδ�ƽ��ʱH2���������Ϊ20%������˵����ȷ����(����)
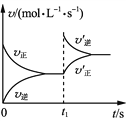
A. t1ʱ�̳���H2��v������v�����仯����ͼ
B. ��һ�δ�ƽ��ʱ��H2���������С��20%
C. �¶�ΪTʱ����ʼ��ԭ�����г���0.1 mol���ۡ�0.04 mol H2O(g)��0.1 mol Fe3O4(s)��0.005 mol H2(g)����Ӧ������Ӧ�������
D. �¶�ΪTʱ�����ѹ�����м�������Fe3O4(s)��0.08 mol H2 (g)����ƽ��ʱH2(g)ת����Ϊ20%
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������李����������������Ҫ�ĸ��Σ��ڹ�ũҵ�����о��й㷺Ӧ�á�
(1) �����������ֻ��������Ͻ�������(��笠�����)��һ��������ӹ��ɵ��Ρ������������ڸ��ε���________(�����)��
A��BaFe2O4����B��NaHSO4����C��KAl(SO4)2��12H2O����D��Ag (NH3)2OH
(2) �������[(NH4)2Ce(NO3)6]���Ʊ��������£�

�١��������õ�CeO2�Ļ�ѧ����ʽΪ________________________________��
��֤��CeO2�Ѿ�ϴ�Ӹɾ��ķ�����_____________________________��
(3) Ϊ�ⶨ�������[(NH4)aMnb(PO4)c��xH2O]����ɣ���������ʵ�飺�ٳ�ȡ��Ʒ2.448 0 g����ˮ�ܽ�����100.00 mL��ҺA������ȡ25.00 mL��ҺA��������NaOH��Һ����ּ��ȣ�����NH3 0.067 20 L(��״��)������ȡ25.00 mL��ҺA���߹Ŀ��������μӰ�ˮ��������ҺpH 6 �� 8����ַ�Ӧ����Һ��Mn2��ת��ΪMn3O4����Mn3O4 0.2290 g��ͨ������ȷ������Ʒ�Ļ�ѧʽ(д���������) __________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
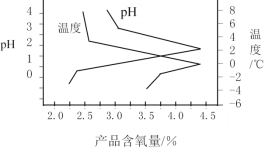
����Ŀ������������ظ����Σ�K2SO4KHSO42KHSO5���ֽ⣬������Ư����NOx��SO2�ȵ��ѳ�����ij�о�С���Ʊ�����������ظ����ε�������ͼ��ʾ��

��֪��Ũ������H2O2��Ӧ������ת��Ϊ�����ᣨ��ѧʽΪH2SO5����һ��һԪǿ�ᣩ
��1��H2SO5����Ԫ�صĻ��ϼ�Ϊ+6�ۣ����й���������ĿΪ________����ҵ���ù���������ظ�������Һ�ѳ�NOʱ����Ӧ�����ӷ���ʽΪ___________________________��
��2������Ӧ�����һ�������������̵���ת�������������ñ�ˮԡ��ȴ���һ�������Ũ���ᣬ��Ŀ����___________________________��
��3�����ᾧ�������У�����K2CO3���ɻ�ù���������ظ����ξ��壬�ù��̵Ļ�ѧ����ʽΪ______________________________������������ظ����β��ʣ��Բ�Ʒ��������ʾ������ҺpH���¶ȵı仯��ϵ��ͼ��ʾ����ù������˵�������_________________��
��4����Ʒ��KHSO5�����IJⶨ��ȡ1.000g��Ʒ����ƿ�У�����������ˮ�ܽ⣬����5mL5���������5mL25����KI��Һ���ټ���1mL������Һ��ָʾ������0.2000mol��L-1��������Ʊ�Һ�ζ����յ㣬���ı�Һ�����Ϊ25.00mL��
��֪��2KHSO5��4KI��H2SO4 = 2I2��3K2SO4��2H2O I2��2Na2S2O3 =Na2S4O6��2NaI
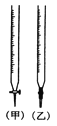
����_____�ζ���ʢװ��Ũ�ȵ������������Һ����������������������
����Ʒ��KHSO5����������Ϊ___________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��PBAT(�ۼ�����Ա������ᶡ��)�ɱ����X����ȫ���⣬��Ϊ��װ��ҽ�ƺ�ũ�ñ�Ĥ����������˲��ϣ������ɾۺ���PBA��PBT�����Ƶã�һ�ֺϳ�·�����£�
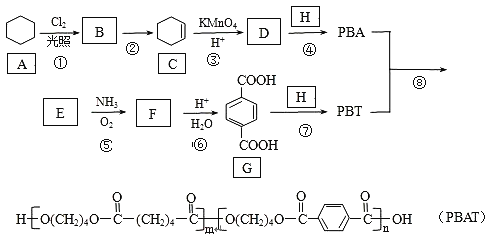
��֪��R��CH3![]() R��CN
R��CN![]() R��COOH
R��COOH
R-CH=CH2![]() R-COOH+CO2
R-COOH+CO2
�ش��������⣺
(1)G�Ĺ����ŵ�����Ϊ________��
(2)�ٵķ�Ӧ����Ϊ___________����Ӧ��������Լ���������___________��
(3)D�Ľṹ��ʽΪ___________��H�Ļ�ѧ����Ϊ___________��
(4)�ݵĻ�ѧ����ʽΪ______________��
(5)M��G��Ϊͬϵ�M����Է���������G��14��N��M��ͬ���칹�壬д��ͬʱ��������������N�Ľṹ��ʽ��___________(д���֣������������칹)��
������FeCl3������ɫ��Ӧ�����ܷ�ˮ�ⷴӦ��������Ӧ��
����NaOH��Һ��Ӧʱ��1mol N������4molNaOH��
�˴Ź�������������壬�������Ϊ1:2:2:2:1��
(6)����ɱ�ϩΪ��ʼԭ���Ʊ�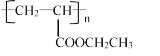 �ĵ���ĺϳ�·��(�����Լ�����ѡ)____________��
�ĵ���ĺϳ�·��(�����Լ�����ѡ)____________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ���¶��£�10mL0.40molL-1H2O2��MnO2�����·�����Ӧ ��2H2O2 ( aq)=2H2O(l )+O2( g) ��H <0�� ��ͬʱ�̲ⶨ����O2�����ʵ������±���ʾ ��
t/min | 0 | 3 | 6 | 10 | ����. |
n(O2)/mol | 0.0 | 0.0008 | 0.001 | 0.0012 | ����. |
������������ȷ���ǣ���Һ����仯���Բ��ƣ�
A.�����¶ȣ��ɼӿ�H2O2 �ķֽ�����
B.��������Һ��ʼŨ�ȣ����ռ��� 0.0 008 mol O2 ��ʱ���С��3 min
C.��Ӧ�� 6min ʱ����Һ �� c(H2O2)=0.2mol L-1
D.��Ӧ�� 12min ʱ��H2O2�ֽ���Ϊ 65%
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��MԪ�ص�1��ԭ��ʧȥ2������ת�Ƶ�YԪ�ص�2��ԭ����ȥ���γɻ�����Z������˵������ȷ����(����)
A. Z�ǹ��ۻ�����
B. Z�ɱ�ʾΪM2Y
C. Z�ĵ���ʽ�ɱ�ʾΪ ![]()
D. M�γɣ�2��������
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com