
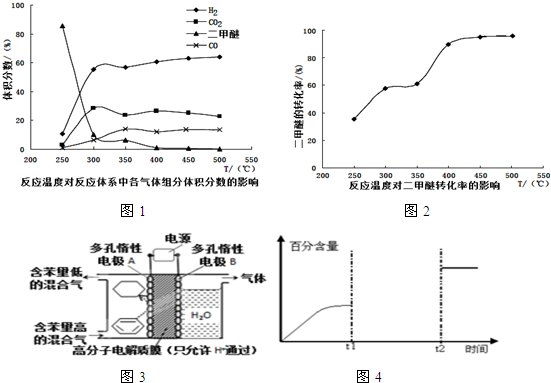
 .
. 分析 (1)①CH3OCH3(g)+H2O(l)?2CH3OH(l)△H=+24.5kJ/mol
②CH3OH(l)+H2O(l)?CO2(g)+3H2(g)△H=+49.01kJ/mol
由盖斯定律可知,①+②×2得:CH3OCH3(g)+3H2O(l)?2CO2(g)+6H2(g),以此计算反应热并书写热化学方程式;
(2)平衡常数为生成物浓度的幂次方之积与反应物浓度的幂次方之积的比;
(3)当化学反应达到平衡状态时,正逆反应速率相等,各物质的浓度不再发生变化,根据密度和平均相对分子质量的公式进行分析解答该题;
(4)①由图可知在400-450℃时,二甲醚的浓度最小,转化率最大;
②温度超过400℃,二甲醚与二氧化碳相同的比例降低,CO与氢气相同的比例升高,说明二甲醚与二氧化碳以1:1反应,生成CO与氢气的比例相同,则反应的方程式为:CH3OCH3+CO2?3H2+3CO;
(5)t1时升高温度,平衡向正反应方向移动,CO2的百分含量增加,据此画图;
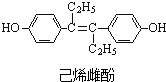
(6)由图可知,左侧苯转化为环己烷,则左侧为阴极,阴极上苯得到电子.
解答 解:(1)①CH3OCH3(g)+H2O(l)?2CH3OH(l)△H=+24.5kJ/mol
②CH3OH(l)+H2O(l)?CO2(g)+3H2(g)△H=+49.01kJ/mol
由盖斯定律可知,①+②×2得:CH3OCH3(g)+3H2O(l)?2CO2(g)+6H2(g)△H=+24.5kJ/mol+49.01kJ/mol×2=+122.52KJ/mol,则热化学方程式为CH3OCH3(g)+3H2O(l)?2CO2(g)+6H2(g)△H=+122.52KJ/mol,
故答案为:CH3OCH3(g)+3H2O(l)?2CO2(g)+6H2(g)△H=+122.52KJ/mol;
(2)③200℃时CO(g)+H2O(g)?CO2(g)+H2(g)△H=-41.17kJ/mol,平衡常数表达式K=$\frac{c(C{O}_{2})c({H}_{2})}{c(CO)c({H}_{2}O)}$,故答案为:$\frac{c(C{O}_{2})c({H}_{2})}{c(CO)c({H}_{2}O)}$;
(3)A.在恒容容器中,体积不变,由CH3OH(l)?CO(g)+2H2(g)反应可得反应前后气体质量在变,所以密度保持不变,证明达到了化学平衡状态,故A正确;
B.由于甲醇为液体,气体的组成一直不变,CO与氢气的物质的量之比一直是1:2,则平均相对分子质量一直不变,所以平均相对分子质量保持不变不能证明达到了化学平衡状态,故B错误;
C.由于甲醇为液体,气体的组成一直不变,CO与氢气的物质的量之比一直是1:2,所以CO的体积分数一直不变,所以CO的体积分数保持不变,不能证明达到了化学平衡状态,故C错误;
D.由于甲醇为液体,气体的组成一直不变,CO与氢气的物质的量之比一直是1:2,所以不能证明达到了化学平衡状态,故D错误.
故答案为:A;
(4)①由图可知在400-450℃时,二甲醚的浓度最小,转化率最大,故答案为:C;
②温度超过400℃,二甲醚与二氧化碳相同的比例降低,CO与氢气相同的比例升高,说明二甲醚与二氧化碳以1:1反应,生成CO与氢气的比例相同,则反应的方程式为:CH3OCH3+CO2?3H2+3CO,
故答案为:可能发生另一种制氢反应为CH3OCH3+CO2?3H2+3CO;
(5)t1时升高温度,平衡向正反应方向移动,CO2的百分含量增加,图象为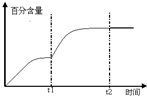 ,
,
故答案为: ;
;
(6)由图可知,左侧苯转化为环己烷,则左侧为阴极,阴极上苯得到电子,则阴极反应式为 ,
,
故答案为: .
.
点评 本题考查较为综合,涉及盖斯定律的应用、化学平衡常数、平衡状态的判断、图表信息的提取与应用及电极反应等,综合性强,侧重分析与应用能力的综合考查,题目难度中等.


科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 与NaOH反应可生成化学式为C18H18O2Na2的化合物 | |
| B. | 聚己烯雌酚含有顺式和反式两种结构 | |
| C. | 1mol己烯雌酚最多可与7molH2发生加成反应 | |
| D. | 形成高分子 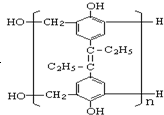 的单体中有己烯雌酚 的单体中有己烯雌酚 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 20 mL 0.1 mol/L CH3COONa溶液与10 mL 0.1 mol/L HCl溶液混合后溶液呈酸性,所得溶液中:c(CH3COO-)>c(Cl-)>c(CH3COOH)>c(H+) | |
| B. | 0.1 mol/L NaHCO3溶液与0.1 mol/L NaOH溶液等体积混合,所得溶液中:c(Na+)>c(CO32-)>c(HCO3-)>c(OH-) | |
| C. | 室温下,pH=2的盐酸与pH=12的氨水等体积混合,所得溶液中:c(H+)+c(Cl-)>c(NH4+)+c(OH-) | |
| D. | 0.1 mol/L CH3COOH溶液与0.1 mol/L NaOH溶液等体积混合,所得溶液中:c(OH-)>c(H+)+c(CH3COOH) |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 元素的离子半径A<B<C<E | |
| B. | 工业上利用电解C的氯化物溶液的方法制备单质C | |
| C. | D的气态氢化物和最高价氧化物的水化物可能发生氧化还原反应 | |
| D. | D与C,A与D形成的化合物中化学键类型相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 离子半径:S2->Na+>O2->H+ | B. | 与水反应的剧烈程度:K>Na>Mg>Ca | ||
| C. | 熔点:CO2>SiO2>Na2O>SO3 | D. | 还原性:PH3>H2S>HCl>HF |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
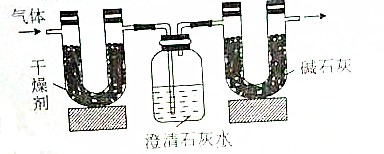
| 实验前 | 实验后 | |
| (干燥剂+U形管)的质量 | 51.10g | 52.45g |
| (澄清石灰水+广口瓶)的质量 | 408.00g | 410.20 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙烯和聚乙烯均能和溴水发生加成反应而使溴水褪色 | |
| B. | 二氧化氯和三氯化铁都常用于自来水的处理,二者的作用原理相同 | |
| C. | Ksp不仅与难溶电解质的性质和温度有关,而且还与溶液中的离子浓度有关 | |
| D. | 7.8g过氧化钠含有的共用电子对数为0.1NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com