
【题目】下列过程中属于物理变化的是( )
A.煤的燃烧
B.碘的升华
C.铜的锈蚀
D.铝的冶炼
科目:高中化学 来源: 题型:
【题目】NA为阿伏加德罗常数的数值,下列说法正确的是( )
A. 0.1 mol H2O2分子中含极性共价键数目为0.3 NA
B. 31g白磷中含有的P-P键数目为NA
C. 标况下22.4L戊烷含有分子数目大于NA
D. 7.2 g CaO2晶体中阴离子和阳离子总数为0.3 NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】请回答下列问题.
(1)久置的硅酸钠溶液会出现浑浊现象其原因为________(用化学方程式表示)
(2)红热的木炭与浓硫酸反应的化学方程式________
(3)SO2催化氧化成SO3的化学方程式:________
(4)写出铜与稀硝酸反应的离子方程式________
(5)实验室制取氨气的化学方程式为 ________,常用________来干燥氨气.
(6)根据反应Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O,回答下列问题:
①还原剂是________,还原产物是_______.
②氧化剂与氧化产物的物质的量比是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是实验室用乙醇与浓硫酸和溴化钠反应来制备溴乙烷的装置,反应需要加热,图中省去了加热装置。有关数据见下表。
乙醇 | 溴乙烷 | 溴 | |
状态 | 无色液体 | 无色液体 | 深红棕色液体 |
密度/g.cm-3 | 0.79 | 1.44 | 3.1 |
沸点/℃ | 78.5 | 38.4 | 59 |
(1)制备操作中,加入的浓硫酸必须进行稀释,其目的是_____(填字母)。
a.减少副产物烯和醚的生成 b.减少Br2的生成
c.减少HBr的挥发 d.水是反应的催化剂
(2)己知加热温度较低时NaBr与硫酸反应生成NaHSO4,写出加热时A中发生的主要反应的化学方程式:________________。
(3)仪器B的名称是________,冷却水应从B的____(填“上“或“下")口流进。
(4)反应生成的溴乙烷应在______(填“A"或"C")中。
(5)若用浓的硫酸进行实验时,得到的溴乙烷呈棕黄色,最好选择下列_____(填字母)溶液来洗涤产品。
a氢氧化钠 b.碘化亚铁 c.亚硫酸钠 d.碳酸氢钠
洗涤产品时所需要的玻璃仪器有_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水中溶氧量(DO)是衡量水体自净能力的一个指标,通常用每升水中溶解氧分子的质量表示,单位mg·L-1。我国《地表水环境质量标准》规定,生活饮用水源的DO不能低于5 mg·L-1。水中溶解氧的测定步骤如下:
(1)向一定量水样中加入适量MnSO4和碱性KI溶液,生成MnO(OH)2沉淀,密封静置;
(2)加入适量稀H2SO4,搅拌,等MnO(OH)2与I-完全反应生成Mn2+和I2后;
(3)用Na2S2O3标准溶液滴定至终点。
测定过程中物质的转化关系如下:
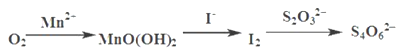
已知:MnO(OH)2+2I-+4H+ =Mn2++I2+3H2O 2S2O32- +I2= S4O62-+2I-
①加入稀硫酸后搅拌的作用是__________;Na2S2O3标准溶液应装在______________滴定管中(填酸式或碱式)。
②滴定过程中以_____________为指示剂;达到滴定终点的标志为____________________。
③写出O2将Mn2+氧化成MnO(OH)2的离子方程式____________________;
④若加入的稀H2SO4溶液反应后,若溶液pH过低,滴定时会产生明显的误差。写出产生误差的一个原因(用离子方程式表示)__________________。
⑤下列操作使测得水样中溶氧量(DO)比实际值偏高的是__________________。
A.第(1)步操作静置时没有密封 B.装Na2S2O3标准溶液的滴定管没有润洗
C.滴定前锥形瓶洗净后没有干燥 D.滴定前读数正确,滴定后俯视读数
⑥取加过一定量CaO2·8H2O的池塘水样l00.00mL,按上述方法测定水中溶解氧量,消耗0.01000
mol·L-1 Na2S2O3标准溶液13.50 mL。计算该水样中的溶解氧为____________mg·L-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在容积固定的密闭容器中,对于反应2SO2(g)+O2(g)![]() 2SO3(g)ΔH<0。下列判断正确的是 ( )
2SO3(g)ΔH<0。下列判断正确的是 ( )
A. 增大反应体系的压强,平衡后SO2的浓度、转化率、体积分数都增加
B. 当单位时间内消耗SO2的物质的量和生成SO3的物质的量相同时,反应达到平衡状态
C. 升高温度,平衡向左移动
D. 充入SO3气体,体系压强增大,平衡向右移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用惰性电极电解下列电解质溶液,有关叙述正确的是( )
A. 等物质的量浓度的NaCl和AlCl3混合液完全电解后,所得的混合液的pH值增大
B. NaCl溶液电解一定时间后,要恢复到电解前状态,应加入适量盐酸
C. Na2SO4溶液在电解过程中,阴极区pH值降低
D. 电解CuSO4溶液,阳极反应式为:2H2O+O2+4e-=4OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
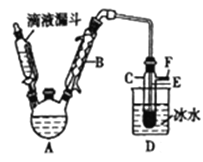
【题目】为了探究一氧化氮、二氧化氮、硝酸之间的相互转化,有同学设计了如下实验:如图将少量铜片装入小试管中,再加人适量稀硝酸,然后迅速将大试管倒扣在小试管外。将套好的大、小试管一起竖立在烧杯中,使水浸没大试管口。充分反应完后,通过弯玻璃管往大试管中吹人足量空气,并往烧杯中滴人几滴紫色石蕊试液。试回答:
(1)写出铜片溶于稀硝酸的离子方程式________。
(2)吹入空气前小试管中的现象是铜片逐渐溶解.溶液变蓝色及________。
(3)假设小试管中加入了 0.192g铜片和5ml浓度为2mol/L的稀硝酸,则充分反应后小试管内溶 液中NO ![]() 物质的量浓度为________mol/L(忽略溶液体积变化)。
物质的量浓度为________mol/L(忽略溶液体积变化)。
(4)若将水换成氢氧化钠溶液,实验过程中生成的一种红棕色气体会与它发生反应,生成两种钠盐和水,且氧化产物与还原产物的物质的量相等,试写出该反应的离子方程式________。
(5)将等质里的铜片分别与等体积过量的浓、稀硝酸反应(假设溶液体积不变 所得溶液前者呈绿色,后者呈蓝色。某同学认为可能是Cu2+浓度的差异引起的,你认为是否正确?________(填“正确”或“不正确”),理由是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由 Al、CuO、Fe2O3 组成的混合物共 10.0g,放入 500mL 某浓度盐酸溶液中,混合物完全溶解,当再 加入 250mL 2.0mol/L 的 NaOH 溶液时,得到的沉淀最多。该盐酸的浓度为( )
A. 0.5 mol/L B. 3.0 mol/L C. 1.0 mol/L D. 2.0 mol/L
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com