
| A、等浓度的:①醋酸,②苯酚,③苯酚钠,④碳酸,⑤碳酸钠,⑥碳酸氢钠.按溶液pH由小到大排列顺序是①④②⑥③⑤ |
| B、标况下,将0.1mol?L-1的氨水溶液中加入氯化铵晶体,若混合溶液pH=7,则c(NH4+)=c(Cl-) |
| C、饱和纯碱(Na2CO3)溶液中:2c(Na+)=c(CO32-)+c(HCO3-)+c(H2CO3) |
| D、0.01 mol?L-1的Na2HPO4溶液中存在如下的平衡:HPO42-+H2O?H2PO4-+OH-;HPO42-?H++PO43-且溶液pH>7;加水稀释后溶液中HPO43-、PO43-、H+的浓度均减小 |


科目:高中化学 来源: 题型:
A、 |
B、 |
C、 |
D、 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、稳定性:H2O>H2S>H2Se |
| B、半径:Na+>Mg2+>F- |
| C、酸性:HClO4>H2SO4>H3PO4 |
| D、碱性:NaOH>Mg(OH)2>Al(OH)3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、等物质的量的硫蒸气和硫固体分别完全燃烧,后者放出的热量少 |
| B、A、B互为同素异形体,由A转化为B时△H═+119 kJ?mol-1可知B比A稳定 |
| C、对△H<0的化学反应,不需要加热,一定能够自发进行到底 |
| D、在101kPa时,H2燃烧的热化学方程式为2H2(g)+O2(g)═2H2O(l)△H═-571.6kJ?mol-1,则H2在101kPa时的燃烧热为571.6kJ?mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、x+y<z |
| B、平衡向逆反应方向移动 |
| C、B的转化率降低 |
| D、C的体积分数下降 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、硫原子的原子结构示意图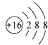 | ||
B、NH4Cl的电子式: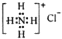 | ||
C、原子核内有10个中子的氧原子:
| ||
| D、基态铜原子的电子排布式为:1s22s22p63s23p63d94s2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、a比b 生成氢气的速率快,生成氢气的总量相同 |
| B、b比a 生成氢气的速率快,生成氢气的总量相同 |
| C、a比b 生成氢气的速率快,生成氢气的总量a比b多 |
| D、a比b 生成氢气的速率快,生成氢气的总量a比b少 |
查看答案和解析>>
科目:高中化学 来源: 题型:
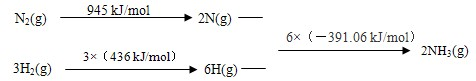
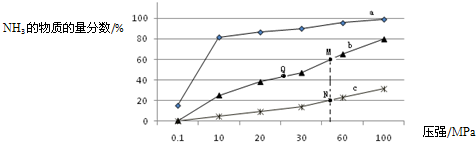
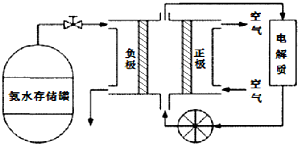
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、c(KNO3)=1.0mol/L的溶液中:Fe2+、Cl-、H+、Na+ | ||
| B、常温下,由水电离出的c(H+)=10-14mol/L溶液中:NH4+、CO32-、CH3COO-、SO42- | ||
| C、加入铝能产生大量氢气的溶液中:CH3CHO、MnO4-、K+、C6H5O- | ||
D、常温下,
|
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com