
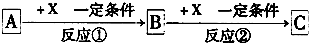
分析 (1)若X是强氧化性单质,A是单质,则A、B、C中含有的相同元素必须是变价元素,结合选项利用代入法验证;
(2)A、B、C均含同一种元素,若B、C 为氧化物,B转化为C时,质量增加25%,B、C分别为SO2、SO3 符合;
(3)若X是一种金属单质,由转化关系可知,D为变价金属,A为强氧化性物质,向C的水溶液中滴入AgNO3溶液,产生不溶于稀HNO3的白色沉淀,则C中含有氯离子,则D为Fe,A为Cl2,符合转化关系,B为FeCl3,C为FeCl2;C溶液在贮存时应加入少量X,目的是防止氯化亚铁溶液被氧化;
(4)A、B、C均含同一种元素,A和C在溶液中反应生成白色沉淀B,沉淀B应为Al(OH)3,X可能为强酸或强碱.
解答 解:(1)若x是强氧化性单质,A是单质,则A、B、C中含有的相同元素必须是变价元素,如X为氧气,S、N2、Na可连续被氧化生成多种氧化物,而Al、Mg分别生成氧化铝、氧化镁,不存在其它氧化物,
故答案为:de;
(2)若B、C为氧化物,B转化为C时,质量增加25%,则A应为S,B为SO2,C为SO3,D为O2,B转化为C的化学方程式是2SO2+O2$\frac{\underline{催化剂}}{△}$2SO3,
故答案为:2SO2+O2$\frac{\underline{催化剂}}{△}$2SO3;
(3)若X为某金属单质,向C的溶液中滴加硝酸银溶液,产生不溶于稀硝酸的白色沉淀,该沉淀为AgCl,说明B、C为氯化物,D为某金属单质,B、D发生化合反应,应为FeCl3和Fe反应,将FeCl3的溶液加热,水解生成氢氧化铁,蒸干再灼烧,氢氧化铁分解生成氧化铁,得到的固体物质是Fe2O3,C溶液在贮存时应加入少量X,目的是防止氯化亚铁溶液被氧化,2Fe3++Fe=3Fe2+,
故答案为:FeCl3;Fe2O3;防止氯化亚铁溶液被氧化,2Fe3++Fe=3Fe2+;
(4)A、B、C均含同一种元素,A和C在溶液中反应生成白色沉淀B,沉淀B应为Al(OH)3,由Al3+和[Al(OH)4]-发生互促水解反应生成,反应的离子方程式为Al3++3[Al(OH)4]-=4Al(OH)3↓,X可能为强酸或强碱,反应①的离子方程式为:Al3++3OH-=Al(OH)3↓,或[Al(OH)4]-+H+=Al(OH)3↓+H2O,
故答案为:Al(OH)3,Al3++3OH-=Al(OH)3↓,或[Al(OH)4]-+H+=Al(OH)3↓+H2O;①③.
点评 本题考查无机物的推断,为高考常见题型,侧重于学生的分析能力和元素化合物知识的综合理解和运用的考查,注意把握A连续与X反应的特点,为解答该题的突破口,题目难度中等.


科目:高中化学 来源: 题型:选择题
| 实验事实 | 结论 | |
| ① | 将某气体通入品红溶液中,品红溶液褪色 | 该气体一定是SO2 |
| ② | 将燃烧的镁条放入CO2中能继续燃烧 | 还原性:Mg>C |
| ③ | NaHCO3溶液与NaAlO2溶液混合产生白色沉淀 | 酸性:HCO3->Al(OH)3 |
| ④ | 常温下白磷可自燃而氮气需在放电时才与氧气反应 | 非金属性:P>N |
| ⑤ | 某无色晶体加入氢氧化钠浓溶液中并加热,产生的气体能使湿润红色石蕊试纸变蓝 | 该晶体中一定有NH4+ |
| A. | ②③⑤ | B. | ①②③ | C. | ③④⑤ | D. | ①③⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径:Z>R>W | |
| B. | 气态氢化物稳定性:HmW>HnR | |
| C. | XW4分子中各原子均满足8电子结构 | |
| D. | Y、Z、R三种元素组成的化合物水溶液一定显碱性 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 少量SO2气体通入NaClO溶液中:SO2+H2O+2ClO-=2HClO+SO32- | |
| B. | 碳酸钙中滴入醋酸溶液:CaCO3+2CH3COOH=Ca2++2CH3COO-+H2O+CO2↑ | |
| C. | 碳酸氢镁溶液中加入过量的澄清石灰水:Mg2++2HCO3-+Ca2++2OH-=CaCO3↓+MgCO3↓+2H2O | |
| D. | 硫酸亚铁溶液中加过氧化氢溶液:2Fe2++2H++H2O2=2Fe3++2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
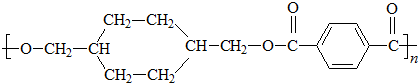
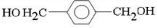 、D
、D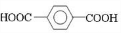 、E
、E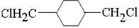 ;
;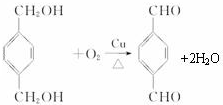
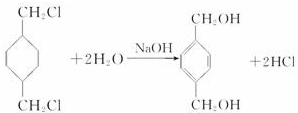 ;
; +
+ $\stackrel{一定条件}{→}$
$\stackrel{一定条件}{→}$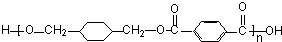 +(2n-1)H2O.
+(2n-1)H2O.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③ | B. | ①③⑤ | C. | ②④⑥ | D. | ②③⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
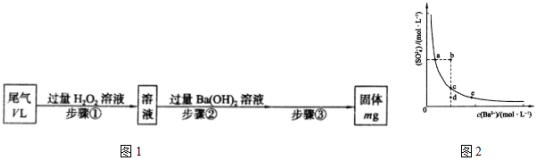
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com