
����Ŀ�����п������õİ�ͷ����������H�ĺϳ�·����ͼ��ʾ��
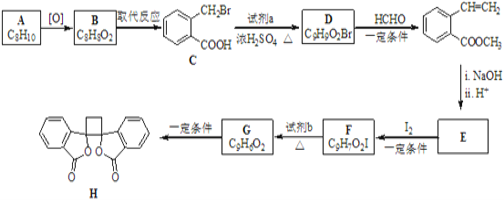
��֪��i.RCH2Br![]() R��HC�TCH��R��
R��HC�TCH��R��
ii��R��HC�TCH��R��![]()
![]()
iii��R��HC�TCH��R��![]()
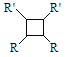 (����R��R'��R'�����⡢�������)
(����R��R'��R'�����⡢�������)
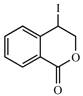
��1��A���ڷ���������������___________��D�Ľṹ��ʽ��________����F����G�ķ�Ӧ������_______________��
��2����E��I2��һ�������·�Ӧ����F�Ļ�ѧ����ʽ��__________���˷�Ӧͬʱ��������һ���л�����������F��Ϊͬ���칹�壬���л�������Ľṹ��ʽ��_______��
��3������˵����ȷ����___________(ѡ����ĸ���)��
A��G����˳���칹��
B����G����H�ķ�Ӧ�Ǽӳɷ�Ӧ
C��1molG��������1molH2�����ӳɷ�Ӧ
D��1molF��1molH������NaOH��Һ��Ӧ��������2molNaOH
��4������ϩΪ��ʼԭ�ϣ������֪��Ϣѡ�ñ�Ҫ�����Լ��ϳ�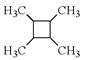 д���ϳ�·��(�ýṹ��ʽ��ʾ�л���ü�ͷ��ʾת����ϵ����ͷ��ע���Լ��ͷ�Ӧ����)��_____��
д���ϳ�·��(�ýṹ��ʽ��ʾ�л���ü�ͷ��ʾת����ϵ����ͷ��ע���Լ��ͷ�Ӧ����)��_____��
���𰸡�1��2�����ױ����ڶ��ױ��� 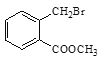 ��ȥ��Ӧ
��ȥ��Ӧ 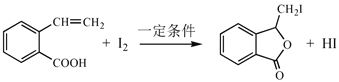
 BD
BD 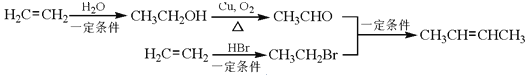
��������
��A�ķ���ʽ�Ա�C�Ľṹ��ʽ��֪AΪ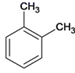 ��BΪ
��BΪ![]() ���Ա�C��D�ķ���ʽ��֪DΪ
���Ա�C��D�ķ���ʽ��֪DΪ![]() ��EΪ
��EΪ![]() ������Ϣii��֪FΪ
������Ϣii��֪FΪ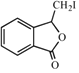 ����H�Ľṹ�����Ϣiii��֪GΪ
����H�Ľṹ�����Ϣiii��֪GΪ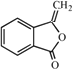 ��
��
��1�������Ϸ�����֪��A�Ľṹ��ʽΪ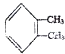 ������Ϊ1��2-���ױ����ڶ��ױ����������Ϸ�����֪��D�Ľṹ��ʽΪ
������Ϊ1��2-���ױ����ڶ��ױ����������Ϸ�����֪��D�Ľṹ��ʽΪ![]() ��F����G�ķ�ӦΪ
��F����G�ķ�ӦΪ ��NaOH����Һ�����¹��ȷ�����ȥ��Ӧ����
��NaOH����Һ�����¹��ȷ�����ȥ��Ӧ���� ���ʴ�Ϊ��1��2-���ױ����ڶ��ױ�����
���ʴ�Ϊ��1��2-���ױ����ڶ��ױ�����![]() ����ȥ��Ӧ��
����ȥ��Ӧ��
��2������Ϣii��֪��![]() ��ⵥ�ʷ�Ӧ����
��ⵥ�ʷ�Ӧ���� ����Ӧ�Ļ�ѧ����ʽΪ
����Ӧ�Ļ�ѧ����ʽΪ ��Ҳ���ܷ�Ӧ���ɸ�����
��Ҳ���ܷ�Ӧ���ɸ�����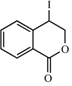 ���ʴ�Ϊ��
���ʴ�Ϊ�� ��
�� ��
��
��3��A��G�Ľṹ��ʽΪ ��̼̼˫��̼ԭ��������2����ԭ�ӣ������ܴ���˳���칹�壬�ʴ���
��̼̼˫��̼ԭ��������2����ԭ�ӣ������ܴ���˳���칹�壬�ʴ���
B��G����̼̼˫��������Ϣiii��֪����G����H�ķ�Ӧ�Ǽӳɷ�Ӧ������ȷ��
C�� G���б�����̼̼˫������1mol G��������4mol H2�����ӳɷ�Ӧ���ʴ���
D�� FΪ ������������I��ˮ�����ɵ��Ȼ���HI����NaOH��Һ��Ӧ��H����2����������ˮ������2���Ȼ�����1mol F��1mol H������NaOH��Һ��Ӧ��������2molNaOH������ȷ��
������������I��ˮ�����ɵ��Ȼ���HI����NaOH��Һ��Ӧ��H����2����������ˮ������2���Ȼ�����1mol F��1mol H������NaOH��Һ��Ӧ��������2molNaOH������ȷ��
BD��ȷ���ʴ�Ϊ��BD��
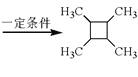
��4������ϩΪ��ʼԭ�Ϻϳ�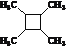 ����������Ϣ��֪��Ӧ������ϩ��ˮ���廯�ⷢ���ӳɷ�Ӧ�����Ҵ��������飬�Ҵ���������ȩ����ȩ�������鷢����Ϣi��Ӧ����CH3CH=CHCH3��CH3CH=CHCH3������Ϣiii��Ӧ����
����������Ϣ��֪��Ӧ������ϩ��ˮ���廯�ⷢ���ӳɷ�Ӧ�����Ҵ��������飬�Ҵ���������ȩ����ȩ�������鷢����Ϣi��Ӧ����CH3CH=CHCH3��CH3CH=CHCH3������Ϣiii��Ӧ���� ���ϳ�·��Ϊ
���ϳ�·��Ϊ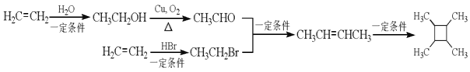 ���ʴ�Ϊ��
���ʴ�Ϊ��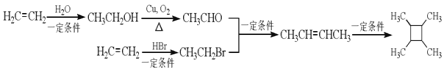 ��
��


 ���Ͱ�ͨ��ĩ���ϵ�д�
���Ͱ�ͨ��ĩ���ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����25��ʱ��FeS��Ksp��6.3��10��18��CuS��Ksp��1.3��10��36��ZnS��Ksp��1.3��10��24�������й�˵������ȷ����
A. ����CuS��Һ��Cu2����Ũ��Ϊ1.3��10��36 mol��L��1
B. 25��ʱ��FeS���ܽ�ȴ���CuS���ܽ��
C. �����ʵ���Ũ����ͬ��FeCl2��ZnCl2�Ļ��Һ�м�������Na2S��ֻ��FeS��������
D. ��ZnS��Һ�м�������ZnCl2���壬ZnS��Ksp���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��ѧ��ȤС������ͼ��ʾװ����ȡ����ء��������ƺ���ˮ�������й�̽��ʵ�顣

ʵ�����ȡ����ء��������ƺ���ˮ
(1)д��װ��Aʵ������ȡCl2�Ļ�ѧ����ʽ______��
(2)��ȡʵ�������ȡ��װ��B���Թܣ���ȴ�ᾧ�����ˡ�ϴ�ӡ���ʵ�����������Ҫ�IJ��������н�ͷ�ιܡ��ձ���________��________��Ϊ�������غʹ������ƵIJ��ʣ���ʵ��װ���л���Ҫ�Ľ�����__________��
(3)װ��C�з�Ӧ��Ҫ�ڱ�ˮԡ�н��У���ԭ����_______��
ʵ���β��������ʵ��С�����ø����չ�����SO2��NaOH��Һ����β���������մ�����
(4)����β��һ��ʱ�������Һ(ǿ����)�п϶�����Cl����OH����SO42-�������ʵ�飬̽��������Һ�п��ܴ��ڵ�����������(�����ǿ�����CO2��Ӱ��)��
�������������
����1��ֻ����SO32-��
����2���Ȳ�����SO32-��Ҳ������ClO����
����3��________��
�����ʵ�鷽��������ʵ�顣��������б���д����Ӧ��ʵ�鲽���Լ�Ԥ������ͽ��ۡ���ѡʵ���Լ���3 mol�� L��1 H2SO4��1 mol�� L��1NaOH��Һ��0.01 mol�� L��1����KMnO4��Һ������KI��Һ��
ʵ�鲽�� | Ԥ������ͽ��� |
����1��ȡ��������Һ������A��B�Թ��� | |
����2����A�Թ��еμ�0.01 mol��L��1����KMnO4��Һ | (1)����Һ��ɫ�������1�� |
(2)����Һ����ɫ�������2��3���� | |
����3��__________ | _________ |
_________ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��298Kʱ����20ml0.1mol/Lij��HA��Һ����μ���0.1mol/LNaOH��Һ�������Һ��pH�仯������ͼ��ʾ������˵��������ǣ� ����
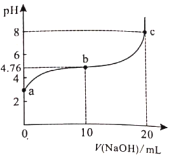
A.HA������B.b����Һ�У�![]()
C.b��c֮��һ������![]() �ĵ�D.a��b��c�����У�c��ˮ�ĵ���̶����
�ĵ�D.a��b��c�����У�c��ˮ�ĵ���̶����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ���¶��£���һ�����ڽ���ijһ��Ӧ��M��N�����ʵ����淴Ӧʱ��仯����������ͼ��ʾ�������������У���ȷ����( )
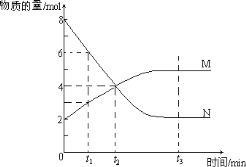
A. ��Ӧ�Ļ�ѧ����ʽһ��Ϊ2M![]() N
N
B. ![]() ʱ���淴Ӧ����һ����������Ӧ����
ʱ���淴Ӧ����һ����������Ӧ����
C. ![]() ʱ����Ӧ�ﵽ�˻�ѧƽ��״̬
ʱ����Ӧ�ﵽ�˻�ѧƽ��״̬
D. ![]() ʱ������Ӧ���ʵ����淴Ӧ����
ʱ������Ӧ���ʵ����淴Ӧ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����t ��ʱ��AgBr��ˮ�еij����ܽ�ƽ��������ͼ��ʾ����֪t ��ʱAgCl��Ksp��4��10��10 mol2��L��2������˵������ȷ����

A.��t ��ʱ��AgBr��KspΪ4.9��10��13 mol2��L��2
B.��AgBr������Һ�м���NaBr���壬��ʹ��Һ��b�㵽c��
C.ͼ��a���Ӧ����AgBr�IJ�������Һ
D.��t ��ʱ��AgCl(s)��Br��(aq)![]() AgBr(s)��Cl��(aq)��ƽ�ⳣ��K��816
AgBr(s)��Cl��(aq)��ƽ�ⳣ��K��816
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����25 ��ʱ����100 mL��14.6 g�Ȼ����������Һ�����5.60 g������(�����Ƿ�Ӧǰ����Һ����ı仯)����Ӧ��ʼ��2 minĩ���ռ���1.12 L(��״��)�������ڴ�֮���־���4 min��������ȫ�ܽ⡣��
(1)��ǰ2 min����FeCl2��ʾ��ƽ����Ӧ������_____________________________��
(2)�ں�4 min����HCl��ʾ��ƽ����Ӧ������______________________________��
(3)ǰ2 min���4 min��ȣ���Ӧ���ʽϿ����_________����ԭ����____________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��11.9g������(Sn)��100mL12mol��L��1 HNO3����һ��ʱ�䡣��ȫ��Ӧ��ⶨ��Һ��c(H��)Ϊ8 mol��L��1����Һ�����Ϊ100mL������������ȫ��������������Һ���գ�������������0.4mol���ɴ��ƶ�������������ǣ� ��
A.SnO2��4H2OB.Sn(NO3)4
C.Sn(NO3)2D.Sn(NO3)2��Sn(NO3)4
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��T ��ʱ��2 L���ܱ�������X(g)��Y(g)������Ӧ����Z(g)����Ӧ������X��Y��Z��Ũ�ȱ仯��ͼ1��ʾ�������������������䣬��Ӧ�¶ȷֱ�ΪT1��T2ʱ��Y�����������ʱ��Ĺ�ϵ��ͼ2��ʾ�������н�����ȷ����
 A����Ӧ���е�ǰ3 min�ڣ���X��ʾ�ķ�Ӧ����v(X)��0.3 mol��(L��min)��1
A����Ӧ���е�ǰ3 min�ڣ���X��ʾ�ķ�Ӧ����v(X)��0.3 mol��(L��min)��1
B�������з����ķ�Ӧ�ɱ�ʾΪ3X(g)��Y(g) ![]() 2Z(g)
2Z(g)
C�����������������䣬�����¶ȣ���Ӧ�Ļ�ѧƽ�ⳣ��K��С
D�����ı䷴Ӧ������ʹ��Ӧ������ͼ3��ʾ����ı������������ѹǿ
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com