
分析 碳酸钠溶液水解显碱性,油污在碱溶液中发生水解生成溶于水的醇和盐,容易洗去;
相同条件下,相同物质的量浓度的Na2CO3溶液和NaHCO3溶液,碳酸钠水解程度大于碳酸氢钠,同浓度时水解程度越大碱性越强,溶液PH越大.
解答 解:碳酸钠溶液水解显碱性,离子方程式为:CO32-+H2O?HCO3-+OH-,
相同条件下,相同物质的量浓度的Na2CO3溶液和NaHCO3溶液,碳酸钠水解程度大于碳酸氢钠,同浓度时水解程度越大碱性越强,溶液PH越大,故pH大小关系为Na2CO3>NaHCO3,
故答案为:>;CO32-+H2O?HCO3-+OH-;>.
点评 本题考查较为综合,涉及弱电解质的电离和盐类的水解等问题,综合考查学生的化学知识应用能力和分析能力,题目难度中等.


 小学学习好帮手系列答案
小学学习好帮手系列答案 小学同步三练核心密卷系列答案
小学同步三练核心密卷系列答案科目:高中化学 来源: 题型:实验题
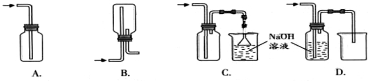
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 除去石英中混有的少量铝粉,可加入氢氧化钠溶液溶解后过滤 | |
| B. | 向含少量FeBr2的FeCl2溶液中,加入适量氯水,再加CCl4萃取,以除去FeCl2溶液中的FeBr2 | |
| C. | 除去乙酸乙酯中混有的少量乙酸,加入饱和氢氧化钠溶液振荡后分液 | |
| D. | 除去CuCl2溶液中混有的少量FeCl3,可向溶液中加入CuO后再过滤 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2O2固体(稀硫酸) | B. | FeCl2溶液(KSCN溶液) | ||
| C. | KI固体(淀粉溶液) | D. | NaOH溶液(盐酸) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
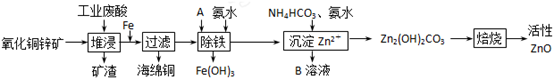
| 离子 | 开始沉淀时的pH | 完全沉淀时的pH |
| Fe2+ | 6.34 | 9.7 |
| Fe3+ | 1.48 | 3.2 |
| Zn2+ | 6.2 | 8.0 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
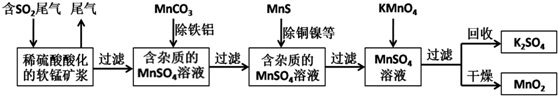
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3.36 L | B. | 4.48 L | C. | 5.6 L | D. | 6.72 L |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
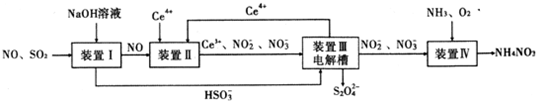
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com