
对乙烯基苯甲酸在医药中间体合成中有着广泛的用途,可用化合物M反应合成。下列关于化合物M和对乙烯基苯甲酸的说法正确的是

A.对乙烯基苯甲酸的分子式为C9H10O2
B.对乙烯基苯甲酸的同分异构体共有三种
C.对乙烯基苯甲酸即属于羧酸,又属于烯烃
D.二者均可发生取代反应和聚合反应
科目:高中化学 来源:2014-2015学年重庆市高三下学期第一次月考理综化学试卷(解析版) 题型:选择题
恒温恒压下,向密闭容器中充入4 mol A和2 mol B,发生反应:2A(g)+ B(g)  2C(g);△H<0。2 min后,反应达到平衡,生成C为1.6 mol。则下列分析正确的是
2C(g);△H<0。2 min后,反应达到平衡,生成C为1.6 mol。则下列分析正确的是
A.若反应开始时容器体积为2 L,则vc=0.4 mol/(Lmin)
B.若在恒压绝热条件下反应,平衡后nc<1.6 mol
C.若2min后,向容器中再投入等物质的量A和C,B的转化率不变
D.若该反应在恒温恒容下进行,放出热量将增加
查看答案和解析>>
科目:高中化学 来源:2014-2015学年山东师大附中高三第七次模拟考试理综化学试卷(解析版) 题型:实验题
(18分)资料显示:“氨气可在纯氧中安静燃烧”。某校化学小组学生设计如下装置(图中铁夹等夹持装置已略去)进行氨气与氧气在不同条件下反应的实验。
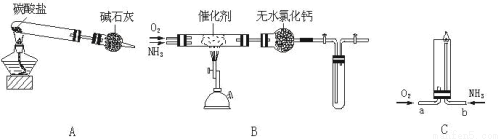
(1)用装置A制取纯净、干燥的氨气,大试管内碳酸盐的化学式是_____ ___________。
(2)将产生的氨气与过量的氧气通到装置B(催化剂为铂石棉)中,用酒精喷灯加热:
①氨催化氧化的化学方程式是 ;试管内气体变为红棕色,该气体是__________________。
②停止反应后,立即关闭B中两个活塞。一段时间后,将试管浸入冰水中,试管内气体颜色变浅,请结合化学方程式说明原因 。
(3)将过量的氧气与A产生的氨气分别从a、b两管进气口通入到装置C中,并在b管上端点燃氨气:
①两气体通入的先后顺序是 。
②氨气燃烧的化学方程式是 。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年山东省枣庄市高三4月模拟考试化学试卷(解析版) 题型:选择题
已知:常温下浓度为0.1 mol·L-1的下列溶液的pH如表:
溶质 | NaF | NaClO | Na2CO3 |
pH | 7.5 | 9.7 | 11.6 |
下列有关说法正确的是。
A.在相同温度下,同浓度的三种酸溶液的导电能力顺序:H2CO3<HClO<HF
B.若将CO2 通入0.1 mol·L-1Na2CO3溶液中至溶液中性,则溶液中2 c (CO32ˉ)+ c (HCO3ˉ)= 0.1 mol·L-1
C.根据上表,水解方程式ClOˉ+ H2O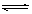 HClO + OHˉ的平衡常数K≈10ˉ7.6
HClO + OHˉ的平衡常数K≈10ˉ7.6
D.向上述NaClO 溶液中通HF气体至恰好完全反应时:c(Na+)>c(Fˉ)>c(H+)>c(HClO)>c(OHˉ)
查看答案和解析>>
科目:高中化学 来源:2014-2015学年山东省高三4月过程性检测理综化学试卷(解析版) 题型:填空题
(16分)金属铝、铁、铜及其化合物与生产、科研关系密切。
(1)工业上可用铝与软锰矿(主要成分为MnO2)反应冶炼金属锰。用化学方程式表示其冶炼原理________。
(2)工业上,采用石墨、铁棒作为电极,电解除去废水中的CN—(C为+4价。下同),装置如图所示,通电过程中,阴、阳两极均有无色无味的气体产生,阳极区两种离子的放电产物会进一步发生反应,其方程式为C12+CNO—+OH— →□+Cl—+CO32-+H2O(未配平)。

①铁电极应连接直流电源的________________(填写电极名称)。
②上述反应方程式配平后“□”内应填写_______。
③阴极产物有______,阳极上发生的电极反应为2Cl--2e-=Cl2↑和______。
(3)用CuSO4溶液为电解质溶液,进行粗铜(含Al、Zn、Ag、Pt、Au等杂质)的电解精炼。下列说法错误的是___________(填写字母代号)。
a.电能全部转化为化学能
b.粗铜接电源正极,发生氧化反应
c.溶液中Cu2+向阳极移动
d.利用阳极泥可回收Ag、Pt、Au等金属
(4)硫酸铝铵水溶液呈酸性,是因为________(填写离子符号)发生了水解;常温下浓度均为0.1 mol·L-1硫酸铝和硫酸铝铵两种水溶液,c(Al3+)较大的是________(填“硫酸铝铵”或“硫酸铝”)溶液。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年宁夏银川一中高三第二次模拟考试 理综化学试卷(解析版) 题型:填空题
【化学——选修物质结构与性质】(15分)A、B、C、D都是元素周期表中的短周期元素,它们的核电荷数依次增大。第2周期元素A原子的核外成对电子数是未成对电子数的2倍,B原子的最外层p轨道的电子为半满结构,C是地壳中含量最多的元素,D原子的S电子与P电子数相等,E是第四周期元素,其原子核外最外层电子数与氢原子相同,其余各层电子均充满。请用对应的元素符号或化学式回答下列问题:
(1)A、B、C的电负性由小到大的顺序为 __;D的稳定离子核外有 种运动状态的电子 .
(2)A的最高价氧化物对应的水化物分子中其中心原子采取 杂化。
(3)已知A、C形成的化合物分子甲与B的单质分子结构相似, 1 mol甲中含有 键的数目为 。
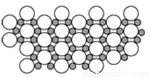
(4)科学家发现硼化D在39K时呈超导性,在硼化D晶体的理想模型中,D原子和硼原子是分层排布的,一层D一层硼相间排列。下图是该晶体微观空间中取出的部分原子沿Z轴方向的投影,白球是D原子投影,黑球是硼原子投影,图中的硼原子和D原子投影在同一平面上。根据图示确定硼化D的化学式为_______。
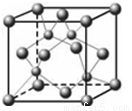
(5)E的外围电子排布式是 ;E的氢化物的晶体结构如下图所示,此氢化物化学式是 ;写出此氢化物在氯气中燃烧的化学方程式 。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年宁夏银川一中高三第二次模拟考试 理综化学试卷(解析版) 题型:选择题
下列有关实验的叙述正确的是
A.用HF溶液可以除去硅晶体中含有的少量二氧化硅晶体
B.向两份Fe3O4固体中分别加入HCl溶液与HI溶液,二者反应原理一样
C.向某溶液中滴加NaOH溶液后又加入酚酞,溶液呈红色,说明原溶液中含有NH4+
D.向某溶液中加入足量的稀HNO3溶液,所得气体能使澄清石灰水变浑浊,证明该溶液中存在CO32 -或HCO3-
查看答案和解析>>
科目:高中化学 来源:2014-2015学年湖南省长沙市高三5月一模化学试卷(解析版) 题型:推断题
芳香烃A可用于制备有机化工原料l,4-二苯基-1,3-丁二烯及某抗结肠炎药物有效成分,合成路线如下(部分反应略去试剂和条件):
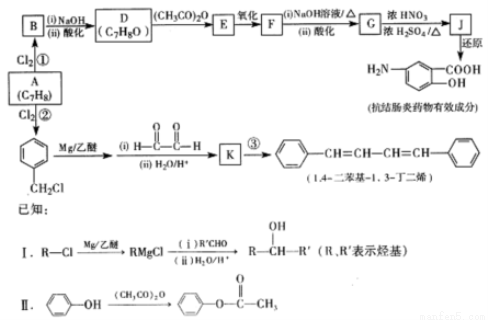
(1)抗结肠炎药物有效成分的分子中含氧官能团的名称是 。
(2)②中的反应条件是 ;G生成J的反应类型是 。
(3)①的化学方程式是 。
(4)F的结构简式是 。
(5)③的化学方程式是 。
(6)设计D→E和F→G两步反应的目的是 。
(7)1,4-二苯基-1,3-丁二烯有多种同分异构体.写出符合下列条件的所有同分异构体的结构简式 。
a.分子中有两个苯环,无其它环状结构
b.苯环上的一元硝基取代产物有两种
查看答案和解析>>
科目:高中化学 来源:2014-2015学年湖南省长沙市高三第二次联考理综化学试卷(解析版) 题型:简答题
(14分)
研究表明丰富的CO2完全可以作为新碳源,解决当前应用最广泛的碳 源(石油和天然气)到本世纪中叶将枯竭的危机,同时又可缓解由CO2累积所产生的温室效应,实现CO2的良性循环。
(1)目前工业上有一种方法是用CO2和H2在230℃催化剂条件下转化生成甲醇蒸汽和水蒸气。下图表示恒压容器中0.5 mol CO2和1.5 mol H2转化率达80%时的能量变化示意图。能判断该反应达到化学平衡状态的依据是_____________。
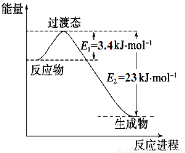
a.容器中压强不变
b.H2的体积分数不变
c.c(H2)=3c(CH3OH)
d.容器中密度不变
e.2个C=O断裂的同时有6个H-H断裂。
(2)将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中,进行反应
CO(g)+H2O(g) CO2(g)+H2(g),得到如下三组数据:
CO2(g)+H2(g),得到如下三组数据:
实验组 | 温度℃ | 起始量/mol[ | 平衡量/mol | 达到平衡所需 时间/min | ||
CO | H2O | H2 | CO | |||
1 | 650 | 4 | 2 | 1.6 | 2.4 | 6 |
2 | 900 | 2 | 1 | 0.4 | 1.6 | 3 |
3 | 900 | a | b | c | d | t |
①实验2条件下平衡常数K= 。
②实验3中,若平衡时,CO的转化率大于水蒸气,则a/b 的值______(填具体值或取值范围)。
③实验4,若900℃时,在此容器中加入CO、H2O、CO2 、H2均为1mol,则此时V正 V逆(填“<”,“>”,“=”)。
(3)已知在常温常压下:
①2CH3OH(l) + 3O2(g) = 2CO2(g) + 4H2O(g) ΔH=-1275.6 kJ/mol
②2CO (g)+ O2(g) = 2CO2(g) ΔH=-566.0 kJ/mol
③H2O(g) = H2O(l) ΔH=-44.0 kJ/mol
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式: 。
(4)已知草酸是一种二元弱酸,草酸氢钠(NaHC2O4)溶液显酸性。常温下,向10 mL 0.01 mol·L-1 H2C2O4溶液中滴加10mL 0.01mol·L-1 NaOH溶液时,比较溶液中各种离子浓度的大小关系 ;
(5)以甲醚、空气、氢氧化钾溶液为原料,石墨为电极可构成燃料电池。该电池的负极反应式为________;
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com