
| 温度/℃ | 700 | 800 | 830 | 1000 | 1200 |
| 平衡常数 | 1.7 | 1.1 | K | 0.6 | 0.4 |
分析 (1)由表格数据可知,温度越高,K越小,则升高温度平衡逆向移动;
(2)830℃时,向一个10L的密闭容器中充入1mol的A和1mol的B,达平衡时,n (D)=0.5mol,则
A(g)+B(g)?C(g)+D(g)
开始 0.1 0.1 0 0
转化 0.05 0.05 0.05 0.05
平衡 0.05 0.05 0.05 0.05
以此计算转化率、K;
(3)结合平衡的特征“等、定”判定平衡状态;
(4)1200℃时反应A(g)+B(g)?C(g)+D(g)的K=0.4,互为逆反应时K互为倒数关系.
解答 解:(1)由表格数据可知,温度越高,K越小,则升高温度平衡逆向移动,则正反应为放热反应,△H<0,
故答案为:<;
(2)830℃时,向一个10L的密闭容器中充入1mol的A和1mol的B,达平衡时,n (D)=0.5mol,则
A(g)+B(g)?C(g)+D(g)
开始 0.1 0.1 0 0
转化 0.05 0.05 0.05 0.05
平衡 0.05 0.05 0.05 0.05
①反应达平衡时,A的平衡转化率为$\frac{0.05}{0.1}$×100%=50%,
故答案为:50%;
②该温度下平衡常数K=$\frac{0.05×0.05}{0.05×0.05}$=1,
故答案为:1;
(3)a.c(A)不再改变,为平衡特征“定”,故选;
b.气体的质量、体积均不变,混合气体的密度始终不变,则不能判定平衡,故不选;
c.该反应为体积不变的反应,则体系内压强始终改变,不能判定平衡,故不选;
d.单位时间内生成C和消耗D的物质的量相等,可知正逆反应速率相等,为平衡状态,故选;
故答案为:ad;
(4)1200℃时反应A(g)+B(g)?C(g)+D(g)的K=0.4,互为逆反应时K互为倒数关系,则1200℃时反应C(g)+D(g)?A(g)+B(g)的平衡常数为$\frac{1}{0.4}$=2.5,故答案为:2.5.
点评 本题考查化学平衡的计算,为高频考点,把握表格数据应用、平衡三段法及K的计算、平衡判定为解答的关键,侧重分析与应用能力的考查,注意K的意义,题目难度不大.


 备战中考寒假系列答案
备战中考寒假系列答案科目:高中化学 来源: 题型:选择题
| A. | Zn(s)+CuSO4(aq)=ZnSO4(aq)+Cu(s)△H=-216 kJ•mol-1,则反应物总能量>生成物总能量 | |
| B. | 相同条件下,如果1 mol氢原子所具有的能量为E1,1 mol 氢分子所具有的能量为E2,则2E1=E2 | |
| C. | 101 kPa时,2H2(g)+O2(g)=2H2O(l)△H=-571.6 kJ•mol-1,则H2的燃烧热为571.6 kJ•mol-1 | |
| D. | H+(aq)+OH-(aq)=H2O(l)△H=-57.3 kJ•mol-1,则1 mol NaOH的氢氧化钠固体与含0.5 mol H2SO4的稀硫酸混合后放出57.3 kJ的热量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 46g NO2和N2O4混合气体中含有原子数为3NA | |
| B. | 标准状况下22.4 L HF中含原子数为2NA | |
| C. | 1L 1mol/L醋酸溶液中离子总数为2NA | |
| D. | 7.1g氯气与足量NaOH溶液反应转移的电子数为0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
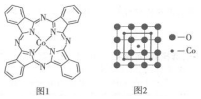 根据所学的物质结构的相关知识回答下列问题:
根据所学的物质结构的相关知识回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c(N2):c(H2)=1:3 | B. | 反应放出92.4 kJ的热量 | ||
| C. | v正(N2)=3v逆(H2) | D. | 容器内气体分子总数不再发生变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③⑤⑥ | B. | ③⑤ | C. | ①②⑤ | D. | ①③④⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
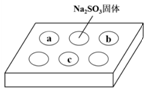 某同学进行SO2的性质实验.在点滴板a、b、c处分别滴有不同的试剂,再向Na2S
某同学进行SO2的性质实验.在点滴板a、b、c处分别滴有不同的试剂,再向Na2S| 序号 | 试剂 | 实验现象 |
| a | 品红溶液 | 红色褪去 |
| b | 酸性KMnO4溶液 | 紫色褪去 |
| c | NaOH溶液(含2滴酚酞) | 红色褪去 |
| A. | 浓硫酸与Na2SO3固体发生了氧化还原反应 | |
| B. | a、b均表明SO2具有漂白性 | |
| C. | c中只可能发生反应:SO2+2OH-═SO32-+H2O | |
| D. | c中所得溶液的离子浓度一定存在关系:c(Na+)+c(H+)=2c(SO32-)+c(HSO3-)+c(OH-) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com