
【题目】由有机物 a 制备有机物 d 的合成路线如图所示。下列说法正确的是( )

A.a 中的所有原子处于同一平面
B.b 的分子式为C10H12,是乙烯的同系物
C.a 的一氯代物有 3 种,d 的一氯代物有 4 种
D.a、b 均可与酸性高锰酸钾溶液反应,c 与 d 互为同分异构体
 小学夺冠AB卷系列答案
小学夺冠AB卷系列答案科目:高中化学 来源: 题型:
【题目】材料的发展与应用促进了人类社会的进步
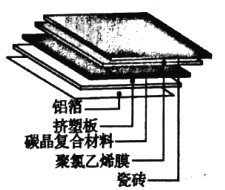
(1)碳晶地暖环保、节能、安全,其构造如图所示。其中属于金属材料的是_____;属于硅酸盐材料的是____;属于高分子材料的是挤塑板和______
(2)吸附材料具有多孔、表面积大的特点,活性炭吸附![]() 的过程中,会伴有C与
的过程中,会伴有C与![]() 的反应,产物为两种常见无毒气体.写出该反应的化学方程式:_____________
的反应,产物为两种常见无毒气体.写出该反应的化学方程式:_____________
(3)![]() 是锂离子电池的一种正极材料,可通过
是锂离子电池的一种正极材料,可通过![]() 与
与![]() 煅烧制备,同时还生成
煅烧制备,同时还生成![]() 和一种单质,写出该反应的化学方程式:________
和一种单质,写出该反应的化学方程式:________
(4)某原电池装置如图所示:
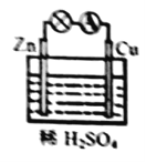
①负极的电极反应式是_______;
②当铜表面析出![]() 氢气(标准状况)时,导线中通过了____
氢气(标准状况)时,导线中通过了____![]() 电子
电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上冶炼锡的第一步反应原理为 2SnO2+3C![]() 2Sn+a M↑+CO2↑,则下列说法中错误的是
2Sn+a M↑+CO2↑,则下列说法中错误的是
A.a 的值为 2B.反应中 SnO2 被还原
C.每生成 1 mol M 转移电子 8 molD.反应后只有一种氧化产物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为确定由硝酸银和硝酸钠组成的混合物中硝酸银的含量,实验室可采用多种方法测定。现取两份不同质量的该混合物进行如下实验:
I.方法一:采用“佛尔哈德法”测定。“佛尔哈德法”可用于测定含银离子的硝酸溶液中银离子的含量,该方法是以铁铵钒[FeNH4(SO4)2·12H2O]为指示剂,NH4SCN溶液为标准溶液。从滴定开始到滴定终点,溶液中发生的主要反应有:
①Ag+(aq)+SCN-(aq)=AgSCN(s)(白色)
②Fe3++SCN-=Fe(SCN)2+(红色)
取14.0 g该混合物溶于蒸馏水配成500 mL待测溶液。取出25.00 mL待测溶液置于锥形瓶中,加入硝酸酸化,然后加水稀释至50 mL滴入指示剂铁铵钒溶液,用0.1000 mol·L-1的NH4SCN标准溶液滴定,消耗标准溶液35.00 mL。
(1)该滴定不能在中性或碱性条件下进行是因为Fe3+会转化为_________(填化学式,下同),Ag+会转化为___________。
(2)当滴入25.00 mL标准溶液时,锥形瓶中_________(填“有”或“没有”)沉淀生成。
(3)滴定终点溶液颜色的变化为________。
(4)称量混合物时,砝码生锈(锈迹未脱落)会导致测得的硝酸银的含量________(填“偏高”或“偏低”或“无影响”)。
(5)该混合物中硝酸银的质量分数为___________(保留三位有效数字)。
II.方法二:取m g该混合物溶于水配成500 mL溶液,取出50.00 mL溶液于锥形瓶中加入过量的稀盐酸充分反应,经“一系列操作”可得到纯净干燥的AgCl固体2.87 g。根据要求回答下列问题:
(6)“一系列操作”的具体步骤为__________、低温干燥。
(7)该混合物质量m=____________(保留三位有效数字)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求填空:
(1)试解释碳酸氢钠水溶液显碱性的原因_____________________________。(用离子方程式和文字叙述解释)
(2)CuSO4的水溶液呈酸性的原因是:________(用离子方程式表示);实验室在配制CuSO4溶液时,需向CuSO4的溶液中加入少量硫酸,其目的是________。
(3)在25℃时,在浓度均为0.1mol/L的下列溶液中:①(NH4)2SO4②(NH4)2CO3③(NH4)2Fe(SO4)2④氨水,其中NH4+的物质的量浓度由小到大的顺序是________(填序号)。
(4)用0.1mol·L-1NaOH溶液分别滴定体积均为20mL、浓度均为0.1mol·L-1的盐酸和醋酸溶液,得到滴定过程中溶液pH随加入NaOH溶液体积而变化的两条滴定曲线。

①滴定醋酸的曲线是___________(填“I”或“Ⅱ”)。
②滴定开始前,0.1mol·L-1NaOH、0.1mol·L-1的盐酸和0.1mol·L-1醋酸三种溶液中由水电离出的c(H+)最大的是_______溶液。
③图I中,V=10时,溶液中的c(H+)_________c(OH-)(填“>”、“=”或“<”,下同),c(Na+)_________c(CH3COO-)。
(5)常温下两种溶液:a.pH=4NH4Cl,b.pH=4盐酸溶液,其中水电离出c(H+)之比为______。
(6)已知:25℃时KSP[Cu(OH)2]=2×10-20。常温下:某CuSO4溶液中c(Cu2+)=0.02molL-1,如要生成Cu(OH)2沉淀,应调整溶液的pH最小为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于氮及其化合物的化学用语正确的是
A.氮原子的结构示意图:![]()
B.氨气的电子式:![]()
C.铜与稀硝酸反应的离子方程式:Cu+4H++2NO3-=Cu2++2NO2↑+2H2O
D.常温时,氯化铵溶液pH<7的原因:NH4++H2O![]() NH3·H2O+H+
NH3·H2O+H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表为元素周期表的一部分,针对表中①~⑧元素,回答下列问题
① | |||||||||||||||
② | ③ | ④ | |||||||||||||
⑤ | ⑥ | ⑦ | ⑧ |
(1)③元素在周期表中的位置是第二周期第_____________族
(2)写出②的最高价氧化物的电子式_____________
(3)⑤和⑥两种元素的最高价氧化物对应水化物中碱性较强的是_____________(填化学式)
(4)写出③和⑦的常见氢化物中稳定性较好的的物质的电子式_____________
(5)写出⑤⑧的最高价氧化物对应水化物互相反应的离子方程式_____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图中反应①是制备SiH4的一种方法,其副产物MgCl2·6NH3是优质的镁资源,下列说法不正确的是
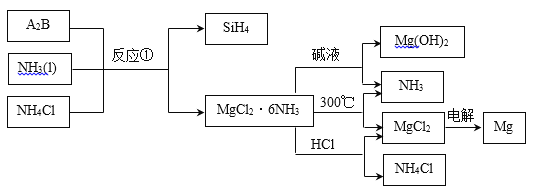
A.A2B的化学式为Mg2Si
B.该流程中可以循环使用的物质是NH3和NH4Cl
C.分别将MgCl2溶液和Mg(OH)2悬浊液加热,灼烧,最终得到的固体不同
D.MgCl2·6NH3所含部分元素的原子半径由小到大的顺序H<Cl<Mg
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电解质溶液中存在多种平衡。请回答下列问题:
(1)已知:
化学式 | CH3COOH | HClO |
电离常数(25℃) | 1.8×10-5 | 3.0×10-8 |
物质的量浓度均为0.1mol/L的下列溶液:a. CH3COOH b. HClO ,比较二者C(H+)的大小:a______b(填“>”、“<”或“=”)。
(2)常温下,将 0.1mol/L 的 CH3COOH 溶液加水稀释,在稀释过程中,下列表达式的数值变大的 __________(填字母)。
A. c(H+) B.  C. c(H+)·c(OH-)
C. c(H+)·c(OH-)
(3)25℃时,体积均为 10mL,pH 均为 2 的醋酸溶液与一元酸 HX 溶液分别加水稀释至 1000mL,稀释过程中 pH 的变化如图所示。已知:pH= -lgC(H+),则:

①25℃时,醋酸的电离常数________HX的电离常数。(填“>”、“<”或“=”)
②稀释100倍后, 醋酸溶液中由水电离出的 c(H+)________ HX溶液中由水电离出的c(H+)。(填“>”、“<”或“=”)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com