
| A、原溶液中至少存在3种离子 |
| B、原溶液中一定不存在的离子是:Cl-、CO32-、OH- |
| C、原溶液中可能存在的离子有:Cl-、Al3+和K+ |
| D、原溶液中一定存在的离子是:NH4+、Fe3+、SO42-和Cl-,且c(Cl-)≥0.2mol/L |
| 0.02 |
| 0.1 |


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
| 第一电离能 | 离子半径 | 熔点 | 酸性 |
| Si | O2- | NaCl | H2SO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
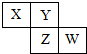
| A、Z元素的原子半径比Y元素的大 |
| B、若Y的最低化合价为-2,则W的最高正化合价为+6 |
| C、若Z的最高正化合价为+5,则X元素的化合物最多 |
| D、若HmZOn为强酸,则Y是活泼非金属元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、将NO2通入FeSO4溶液中不会有明显现象 |
| B、2L 0.5mol/L的盐酸和1L 0.5mol/L的硫酸PH相等 |
| C、饱和氯水中:c(H+)>c(Cl-)>c(HClO)>c(ClO-) |
| D、同温同压下,H2(g)+Cl2(g)═2HCl(g)在光照和点燃条件下反应的△H不相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、向氢氧化钠溶液中加入少量铝粉:2Al+2OH-+2H2O═2AlO2-+3H2↑ |
| B、NH4HCO3溶液与足量Ba(OH)2溶液混合:HCO3-+Ba2++OH-═BaCO3↓+H2O |
| C、硫化钠溶液显碱性的原因:S2-+H2O═H2S+2OH- |
| D、向FeBr2溶液中通入足量氯气:2Fe2++2Br-+2Cl2═2Fe3++Br2+4Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| X | Y | Z | |
| ① | NaOH溶液 | Al(OH)3 | 稀硫酸 |
| ② | KOH溶液 | SiO2 | 浓盐酸 |
| ③ | O2 | N2 | H2 |
| ④ | FeCl3溶液 | Cu | 浓硝酸 |
| A、①③ | B、①④ | C、②④ | D、②③ |
查看答案和解析>>
科目:高中化学 来源: 题型:
 在恒容密闭容器中通入X并发生反应:2X(g)?Y(g),温度T1、T2下X的物质的量浓度c(X)随时间t变化的曲线如图所示.下列叙述正确的是( )
在恒容密闭容器中通入X并发生反应:2X(g)?Y(g),温度T1、T2下X的物质的量浓度c(X)随时间t变化的曲线如图所示.下列叙述正确的是( )| A、该反应进行到M点放出的热量大于进行到W点放出的热量 | ||
B、T2下,在0~t1时间内,v(Y)=
| ||
| C、M点的正反应速率V正大于N点的逆反应速率V逆 | ||
| D、M点时再加入一定量X,平衡后X的转化率减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:
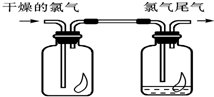 (1)如图所示,将氯气依次通过盛有干燥有色布条的广口瓶和盛有潮湿有色布条的广口瓶,可观察到的现象是
(1)如图所示,将氯气依次通过盛有干燥有色布条的广口瓶和盛有潮湿有色布条的广口瓶,可观察到的现象是查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com