
【题目】将铁与氧化铁的混合物15克,加入150mL稀硫酸中,标况下放出氢气1.68升,同时铁和氧化铁均无剩余,向溶液中滴加KSCN溶液,未见颜色变化.
(1)混合物中铁的质量为g.
(2)为使Fe2完全转化为Fe(OH)2 , 共消耗3molL﹣1的氢氧化钠溶液200mL,则原硫酸的物质的量浓度为 .
【答案】
(1)7
(2)2mol/L
【解析】解:(1)由题意可知,反应后的溶液中Fe元素的存在形式为Fe2+ , 故发生反应有:Fe2O3+3H2SO4=Fe2(SO4)3+3H2O、Fe+Fe2(SO4)3=3FeSO4、Fe+H2SO4=FeSO4+H2↑,
生成氢气的物质的量为:n(H2)= ![]() =0.075mol,
=0.075mol,
与H2SO4反应的铁的物质的量为:n(Fe)=n(H2)=0.075mol,
综合前两个反应方程式可知:与Fe2(SO4)3反应的铁为 n(Fe)ˊ=n[Fe2(SO4)3]=n(Fe2O3),
铁与氧化铁的总质量为15g,则:(n(Fe)ˊ+0.075mol)×56g/mol+n(Fe)ˊ×160g/mol=15g,
解得:n(Fe)ˊ=0.05mol,
混合物中铁的物质的量为:n(Fe)=0.075mol+0.05mol=0.125mol,
所以混合物中铁的质量为:m(Fe)=0.125mol×56g/mol=7g,
故答案为:7;(2)中和过量的H2SO4 , 且使Fe2+完全转化成Fe(OH)2 , 反应后的溶液中溶质为Na2SO4 ,
则:n(H2SO4)=n(Na2SO4)= ![]() n(NaOH)=
n(NaOH)= ![]() ×3mol/L×0.2L=0.3mol,
×3mol/L×0.2L=0.3mol,
原硫酸的浓度为:c(H2SO4)= ![]() =2mol/L,
=2mol/L,
故答案为:2mol/L.
(1)向溶液中滴入KSCN溶液,未见颜色变化,说明硫酸过量,反应后溶液中铁元素完全转化成亚铁离子,据此写出反应的化学方程式;根据反应方程式计算出混合物中单质铁的质量;(2)将Fe2完全转化为Fe(OH)2 , 此时溶质为硫酸钠,根据质量守恒计算出原硫酸的物质的量浓度.


 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案科目:高中化学 来源: 题型:
【题目】有机化学反应因反应不同,可生成不同的有机产品.例如: (i) 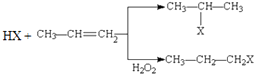 (X为卤素原子)
(X为卤素原子)
(ii)苯的同系物与卤素单质混合,若在光照条件下,侧链上氢原子被卤素原子取代;若在催化剂作用下,苯环上的氢原子被卤素原子取代.
工业上利用上述信息,按下列路线合成结构简式为 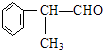 的物质,该物质是一种香料.
的物质,该物质是一种香料.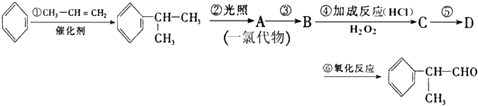
请根据上述路线,回答下列问题:
(1)A的结构简式可能为;
(2)反应①、③、⑤的反应类型分别为、、;
(3)反应④的化学方程式为(有机物写结构简式,并注明反应条件);
(4)工业生产中,中间产物A须经反应③④⑤得D,而不采取直接转化为D的方法,其原因是;
(5)这种香料具有多种同分异构体,其中某些物质有下列特征:①其水溶液遇FeCl3溶液呈紫色 ②分子中有苯环,且苯环上的一溴代物有两种.写出符合上述条件的物质可能的结构简式(只写一种)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将少量SO2通入Ca(ClO)2溶液中,下列离子方程式能正确表示该反应的是( )
A.SO2+H2O+Ca2++2ClO﹣→CaSO4↓+HClO+H++Cl﹣
B.SO2+H2O+Ca2++2ClO﹣→CaSO3↓+2H++2ClO﹣
C.SO2+H2O+Ca2++2ClO-→CaSO3↓+2HClO
D.SO2+H2O+Ca2++2ClO-→CaSO4↓+2H++Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用Na2SO3还原MnO4-,如果还原含有2.4×10-3 mol MnO4-的溶液时,消耗18 mL0.2mol/L的Na2SO3 溶液,则Mn元素在还原产物中化合价为()
A. +1 B. +2 C. +4 D. +5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是
A. 1 mol ![]() 中,电子的物质的量为11 mol
中,电子的物质的量为11 mol
B. 将4g NaOH溶解于1 L水中所得溶液物质的量浓度为1 mol·L![]()
C. 等质量的臭氧(O![]() )与氧气所含的原子数相等
)与氧气所含的原子数相等
D. 标准状况下1mol任何物质体积均约为22.4L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】与30 mL 0.1 mol/L的![]() 溶液中
溶液中![]() 的物质的量浓度相等的是
的物质的量浓度相等的是
A. 15 mL 0.2mol/L的![]() 溶液
溶液
B. 30 mL 0.1mol/L的![]() 溶液
溶液
C. 10 mL 0.2mol/L的![]() 溶液
溶液
D. 30 mL 0.3mol/L的NaCl溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据题意解答
(1)Fe3+具有氧化性,实验室测定含碘废液中I﹣的含量的过程如下:量取25.00mL废液于250mL锥形瓶中,分别加入5mL 2molL﹣1 H2SO4和10mL 20% Fe2(SO4)3溶液,摇匀.小火加热蒸发至碘完全升华,取下锥形瓶冷却后,加入几滴二苯胺磺酸钠(用作指示剂),用0.02500molL﹣1标准K2Cr2O7溶液进行滴定到终点.重复3次,数据记录如表:
次数 | 1 | 2 | 3 |
滴定体积/mL | 19.98 | 20.02 | 19.00 |
(i)在盛有废液的锥形瓶中先加入5mL 2molL﹣1 H2SO4的目的是 . (用离子方程式和语言叙述解释)
(ii)上述过程中涉及的反应:①2Fe3++2I﹣═2Fe2++I2② .
(iii)根据滴定有关数据,该废液中I﹣含量是gL﹣1 .
(iv)在滴定过程中,下列操作(其他操作正确)会造成测定结果偏低的是 .
A.终点读数时俯视读数,滴定前平视读数
B.锥形瓶水洗衣后未干燥
C.滴定管未用标准K2Cr2O7溶液润洗
D.盛标准K2Cr2O7溶液的滴定管,滴定前有气泡,滴定后无气泡.
(2)Fe3+和Ag+的氧化性相对强弱一直是实验探究的热点.某学习小组同学设计如下实验:
实验编号 | 实验操作 | 现象 |
1 | 向10mL 3mol/L KNO3酸性溶液(pH=1)中插入一根洁净的Ag丝,并滴加NaCl溶液 | 无白色沉淀生成 |
2 | 向10mL 1mol/L AgNO3溶液中滴加2mL 0.1mol/L FeSO4溶液,振荡,再滴加酸性KMnO4溶液 | 紫红色不褪去 |
3 | 向10mL 1mol/L Fe(NO3)3酸性溶液(pH=1)中插入一根洁净的Ag丝,并滴加NaCl溶液 | 有白色沉淀生成 |
请回答:
(i)设计实验①的目的是 .
(ii)实验③可得出结论是 .
(iii)写出实验②中反应的离子方程式
(iv)根据以上实验,Fe3+和Ag+的氧化性相对强弱与离子有关.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com