
A.4 B.7.2 C.10 D.11.3
科目:高中化学 来源: 题型:013
用0.1mol×L-1 NaOH溶液滴定100mL0.1mol×L-1盐酸时,如果滴定误差在±0.1%以内,反应完毕后,溶液的pH范围为( )
A.6.9~7.1 B.3.3~10.7
C.4.3~9.7 D.6~8
查看答案和解析>>
科目:高中化学 来源:物理教研室 题型:013
A.6.9~7.1 B.3.3~10.7 C.4.3~9.7 D.6~8
查看答案和解析>>
科目:高中化学 来源: 题型:022
某化学课外小组为测定空气中CO2的含量,进行了如下实验:
①配制0.1mol×L-1的标准盐酸和0.01mol×L-1标准盐酸②用0.1mol×L-1的标准盐酸滴定未知的Ba(OH)2溶液10mL,结果用去盐酸19.60mL ③用测定的Ba(OH)2溶液吸收定量空气中的CO2。取Ba(OH)2溶液10mL,放入100mL容量瓶里加水至刻度线。取出稀释后的溶液放入密闭容器内,并通入10L标况下的空气,振荡,这时生成沉淀 ④过滤。过滤上述所得浊液 ⑤取滤液20mL,用0.01mol×L-1盐酸滴定,用去盐酸34.80mL。请回答下列问题:
(1)配制标准盐酸时,需用下列哪些仪器______________。
A.托盘天平 B.容量瓶 C.酸式滴定管 D.量筒 E.烧杯 P.胶头滴管 G.玻璃棒
(2)滴定操作中,左手_________,右手___________眼睛__________。
(3)Ba(OH)2溶液的物质的量浓度是__________________。
(4)过滤所得浊液的目的是_______________。
(5)此空气样品中含CO2的体积分数为_________________。
(6)本实验中,若第一次滴定时使用的酸式滴定管未经处理,即注入第二种标准盐酸,并进行第二次滴定,使测定结果_________(填“偏大”或“偏小”或“无影响”)。
查看答案和解析>>
科目:高中化学 来源:2011年普通高等学校招生全国统一考试化学卷(安徽) 题型:实验题
地下水中硝酸盐造成的氮污染已成为一个世界性的环节问题。文献报道某课题组模拟地下水脱氮过程,利用Fe粉和KNO3溶液反应,探究脱氮原理及相关因素对脱氮速率的影响。
(1)实验前:①先用0.1mol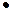 L-1H2SO4洗涤Fe粉,其目的是 ,然后用蒸馏水洗涤至中性;②将KNO3溶液的pH调至2.5;③为防止空气中的O2对脱氮的影响,应向KNO3溶液中通入 (写化学式)。
L-1H2SO4洗涤Fe粉,其目的是 ,然后用蒸馏水洗涤至中性;②将KNO3溶液的pH调至2.5;③为防止空气中的O2对脱氮的影响,应向KNO3溶液中通入 (写化学式)。
(2)右图表示足量Fe粉还原上述KNO3溶液过程中,测出的溶液中相关离子浓度、pH随时间的变化关系(部分副反应产物曲线略去)。请根据图中信息写出t1时刻前该反应的离子方程式 。t1时刻后,改反应仍在进行,溶液中N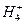 的浓度在增大,Fe2+的浓度却没有增大,可能的原因是 。
的浓度在增大,Fe2+的浓度却没有增大,可能的原因是 。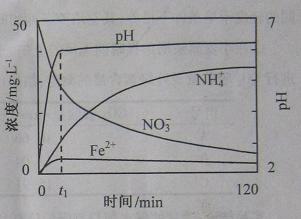
(3)改课题组对影响脱氮速率的因素提出了如下假设,请你完成假设二和假设三:
假设一:溶液的pH;
假设二: ;
假设二: ;
(4)请你设计实验验证上述假设一,写出实验步骤及结论。(已知:溶液中的N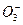 浓度可用离子色谱仪测定
浓度可用离子色谱仪测定
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com