
【题目】下列有关物质性质的叙述一定不正确的是
A. 向FeCl2溶液中滴加NH4SCN溶液,溶液显红色
B. KAl(SO4) 2·12H2O溶于水可形成 Al(OH)3胶体
C. NH4Cl与Ca(OH)2混合加热可生成NH3
D. Cu与FeCl3溶液反应可生成CuCl2
【答案】A
【解析】分析:A项,NH4SCN用于检验Fe3+;B项,KAl(SO4)2·12H2O溶于水电离出的Al3+水解形成Al(OH)3胶体;C项,实验室可用NH4Cl和Ca(OH)2混合共热制NH3;D项,Cu与FeCl3溶液反应生成CuCl2和FeCl2。
详解:A项,FeCl2溶液中含Fe2+,NH4SCN用于检验Fe3+,向FeCl2溶液中滴加NH4SCN溶液,溶液不会显红色,A项错误;B项,KAl(SO4)2·12H2O溶于水电离出的Al3+水解形成Al(OH)3胶体,离子方程式为Al3++3H2O![]() Al(OH)3(胶体)+3H+,B项正确;C项,实验室可用NH4Cl和Ca(OH)2混合共热制NH3,反应的化学方程式为2NH4Cl+Ca(OH)2
Al(OH)3(胶体)+3H+,B项正确;C项,实验室可用NH4Cl和Ca(OH)2混合共热制NH3,反应的化学方程式为2NH4Cl+Ca(OH)2![]() CaCl2+2NH3↑+2H2O,C项正确;D项,Cu与FeCl3溶液反应生成CuCl2和FeCl2,反应的化学方程式为Cu+2FeCl3=CuCl2+2FeCl2,D项正确;答案选A。
CaCl2+2NH3↑+2H2O,C项正确;D项,Cu与FeCl3溶液反应生成CuCl2和FeCl2,反应的化学方程式为Cu+2FeCl3=CuCl2+2FeCl2,D项正确;答案选A。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】最近科学家发现了一种新分子,它具有空心的类似足球的结构,分子式为C60,下列说法正确的是
A.C60是一种新型的化合物
B.C60和石墨都是碳的同素异形体
C.C60中虽然没有离子键,但固体为离子晶体
D.C60相对分子质量为360
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列溶液中微粒的物质的量浓度关系正确的是
A. 25 ℃时,向0.1 mol·L-1 NH4HSO4溶液中滴加NaOH溶液至中性:c(Na+)>c(NH)>c(SO![]() )>c(OH-)=c(H+)
)>c(OH-)=c(H+)
B. 25 ℃时,NaB溶液的pH=8,c(Na+)-c(B-)=9.9×10-7 mol·L-1
C. 0.1![]()
![]() 溶液:
溶液:![]()
D. 相同物质的量浓度的CH3COONa和NaClO的混合液中,各离子浓度的大小关系是:c(Na+)>c(ClO-)>c(CH3COO-)>c(OH-)>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过碳酸钠(Na2CO3·3H2O2) 在洗涤、纺织、医药等领域有广泛应用。一种制备过碳酸钠的工艺流程如图所示。
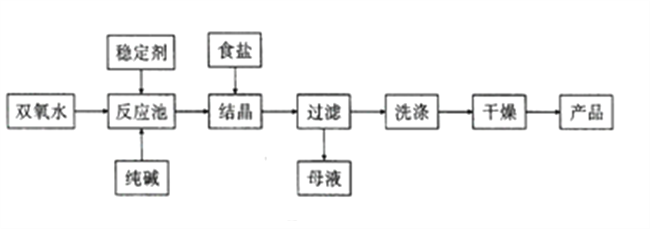
(1)碳酸钠水溶液呈碱性的原因是____________(用离子方程式表示),为增强洗涤效果,可采取最简单的措施是________________。
(2)过碳酸钠受热易分解,写出反应的化学方程式:__________________
(3)稳定剂可能是_____(填序号)。
A.Na2SO3 B.Na2SiO3 C.H2SO4 D.MnO2
(4)结晶时加入食盐的目的是_________,母液中可循环使用的物质是_________(填化学式)。
(5)工业上常以过碳酸钠产品中活性含氧量![]() 来衡量产品优劣,13%以上的为优质品。产品中活性氧含量的测定方法: 称量m g 样品,在250mL 锥形瓶中用100mL 0.5mol/L硫酸完全溶解,立即用c mol/L的高锰酸钾标准溶液进行滴定,至滴定终点,过程中MnO2被还原为Mn2+,进行三次滴定,测得消耗标准溶液平均体积为V1mL。另外,在不加样品的情况下按照上述过程进行空白实验,消耗高锰酸钾溶液的体积为V2 mL。该产品活性氧含量为________(用代数式表示)。
来衡量产品优劣,13%以上的为优质品。产品中活性氧含量的测定方法: 称量m g 样品,在250mL 锥形瓶中用100mL 0.5mol/L硫酸完全溶解,立即用c mol/L的高锰酸钾标准溶液进行滴定,至滴定终点,过程中MnO2被还原为Mn2+,进行三次滴定,测得消耗标准溶液平均体积为V1mL。另外,在不加样品的情况下按照上述过程进行空白实验,消耗高锰酸钾溶液的体积为V2 mL。该产品活性氧含量为________(用代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】储氢材料是科学研究的热点之一。
(1)无机盐储氢原理:NaHCO3(s)+H2(g) ![]() HCOONa+H2O,HCOONa中的化学键类型有____;在NaHCO3中,C、H、O的电负性由大到小的顺序为_________。
HCOONa+H2O,HCOONa中的化学键类型有____;在NaHCO3中,C、H、O的电负性由大到小的顺序为_________。
(2)近年来,研究人员发现苯和甲苯都是比较理想的有机液体储氢材料。C6H6(苯)+3H2![]() C6H12(环已烷);C6H5-CH3(甲苯)+3H2
C6H12(环已烷);C6H5-CH3(甲苯)+3H2![]() C6H11-CH3(甲基环己烷)
C6H11-CH3(甲基环己烷)
①甲苯分子中碳原子的杂化类型是__________;
②能体现环已烷分子的空间构型的键线式为____________。
(3)金属钛具有较强的储氢能力。钛的储氢反应为Ti+H2![]() TiH2。工业上,冶炼钛的原理是钛的氧化物在高温下与焦炭、氯气反应生成TiCl4和CO。
TiH2。工业上,冶炼钛的原理是钛的氧化物在高温下与焦炭、氯气反应生成TiCl4和CO。
①CO能形成Ni(CO)4,沸点为42.2℃,Ni(CO)4的晶体类型为______________,CO与N2互为等电子体,标准状况下,VL CO分子形成Ni(CO)4中含o键数目为________。
②基态钛原子中电子能量最高的电子排布图为_________
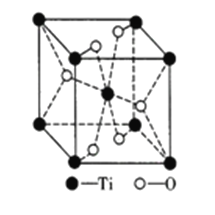
③钛的氧化物晶胞如图所示。该钛的氧化物晶体的化学式为_______已知钛的氧化物晶胞参数为a·10-3μm,NA代表阿伏加德罗常数的值,则该晶体的密度为_______g·cm-3。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列指定反应的离子方程式正确的是
A. NO2通入水中:3NO2+H2O=2H++2NO2-+NO
B. Fe(OH)3溶于HI溶液:Fe(OH)3+3H+=Fe3++3H2O
C. (NH4)2SO4溶液中加入Ba(OH)2溶液:NH4++SO42-+Ba2++OH-=BaSO4↓+NH3·H2O
D. 向NaAlO2溶液中滴入NaHCO3溶液产生白色沉淀:AlO2-+HCO3-+H2O=Al(OH)3↓+CO![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】温度为T1时,在三个容积均为1L的恒容密闭容器中仅发生反应:2NO2(g) =2NO(g)+O2(g) (正反应吸热)。实验测得:v正= v(NO2)消耗= k正c2(NO2) v逆=v(NO)消耗=2v(O2)消耗=k逆c2(NO)·c(O2),k正、k逆为速率常数,受温度影响。下列说法不正确的是
容器 编号 | 物质的平衡浓度(mol/L) | 物质的起始浓度(mol/L) | ||
c(NO2) | c(NO) | c(O2) | c(O2) | |
Ⅰ | 0.6 | 0 | 0 | 0.2 |
Ⅱ | 0.3 | 0.5 | 0.2 | |
Ⅲ | 0 | 0.5 | 0.35 | |
A. 温度为T1,反应达平衡时,容器Ⅲ中的平衡常数K=0.8
B. 达平衡时,速率常数和化学平衡常数的关系K= k正/k逆
C. 当温度改变为T2时,若k正=k逆则T21
D. 容器Ⅱ反应达平衡前,v正>v逆
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com