
| 时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
| C(NO)/mol?L-1 | 1.00×10-3 | 4.50×10-4 | 2.50×10-4 | 1.50×10-4 | 1.00×10-4 | 1.00×10-4 |
| C(CO)/mol?L-1 | 3.60×10-3 | 3.05×10-3 | 2.85×10-3 | 2.75×10-3 | 2.70×10-3 | 2.70×10-3 |
| 实验编号 | T/℃ | NO初始浓度/mol?L-1 | CO初始浓度/mol?L-1 | 催化剂的比表面积/m2?g-1 |
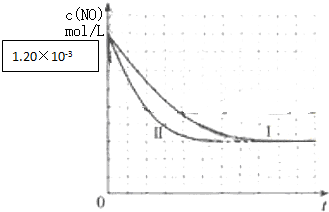
| Ⅰ | 280 | 1.20×10-3 | 5.80×10-3 | 82 |
| Ⅱ | 124 | |||
| Ⅲ | 350 | 124 |
| 转化量 |
| 总量 |
| 1.00×10 -3-2.5×10 -4 |
| 2s |
| 1.0×10 -3-1.0×10 -4 |
| 1.0×10 -3 |
| 实验 编号 | t(℃) | NO初始浓度 (mol/L) | CO初始浓度 (mol/L) | 催化剂的 比表面积(m2/g) |
| Ⅰ | ||||
| Ⅱ | 280 | 1.20×10-3 | 5.80×10-3 | |
| Ⅲ | 1.20×10-3 | 5.80×10-3 |
 ,
, .
.


科目:高中化学 来源: 题型:
| A、前者多 | B、后者多 |
| C、一样多 | D、无法确定 |
查看答案和解析>>
科目:高中化学 来源: 题型:
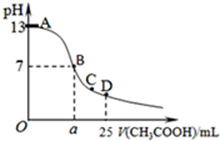 某温度时,在25mL 0.1mol/L NaOH溶液中逐滴加入0.2mol/L CH3COOH溶液,曲线如图乙所示,有关粒子浓度关系的比较正确的是
某温度时,在25mL 0.1mol/L NaOH溶液中逐滴加入0.2mol/L CH3COOH溶液,曲线如图乙所示,有关粒子浓度关系的比较正确的是| A、在D点:c(CH3COO-)+c(CH3COOH)=2c(Na+) |
| B、在C点:c(CH3COO-)>c(Na+)>c(OH-)>c(H+) |
| C、在B点,a>12.5,且有c(Na+)=c(CH3COO-)=c(OH-)=c(H+) |
| D、在A、B间任一点,溶液中一定都有c(Na+)>c(CH3COO-)>c(OH-)>c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:
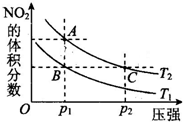 请回答下列问题
请回答下列问题查看答案和解析>>
科目:高中化学 来源: 题型:
| 温度 | 时间/min 物质的量 | 0 | 10 | 20 | 40 | 50 |
| T1 | n(CH4)/mol | 0.50 | 0.35 | 0.25 | 0.10 | 0.10 |
| T2 | n(CH4)/mol | 0.50 | 0.30 | 0.18 | x | 0.15 |
| A、T1>T2,且a>0 |
| B、当温度为T2、反应进行到40 min时,x>0.15 |
| C、温度为T2时,若向平衡后的容器中再充入0.50 mol CH4和1.2mol NO2,重新达到平衡时,n(N2)=0.70mol |
| D、温度为T1时,若起始时向容器中充入0.50 mol CH4(g)、0.50 molNO2(g)、1.0 mol N2(g)、2.0 molCO2(g)、0.50 molH2O(g),反应开始时,ν(正)>ν(逆) |
查看答案和解析>>
科目:高中化学 来源: 题型:
 四种常见元素的性质或结构信息如下表.试根据信息回答有关问题.
四种常见元素的性质或结构信息如下表.试根据信息回答有关问题.| 元素 | A | B | C | D |
| 性质 结构 信息 | 原子核外有两个电子层,最外层有3个未成对的电子 | 原子的M层有1对成对的p电子 | 原子核外电子排布为[Ar]3d104sx,有+1、+2两种常见化合价 | 有两种常见氧化物,其中有一种是冶金工业常用的还原剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 矿物透闪石是制作玉器的一种原料,其化学式可用CaxMgySi8O22(OH)m表示.
矿物透闪石是制作玉器的一种原料,其化学式可用CaxMgySi8O22(OH)m表示.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com