

| A. | 该电池总反应为:4NH3+3O2═2N2+6H2O | |
| B. | a极的电极反应为:2NH3-6e-═N2+6H+ | |
| C. | b极的电极反应为:4OH--4e-═2H2O+O2↑ | |
| D. | a极每产生1molN2,约有6×6.02×1023个OH-迁移至b极 |
分析 燃料电池中,负极上是燃料氨发生失电子的氧化反应,负极反应为:2NH3-6e-+6OH-═N2+6H2O;正极上氧气得电子生成氢氧根离子,正极反应为:O2+4e-+2H2O=4OH-;溶液中阴离子向负极移动,据此分析.
解答 解:A.该燃料电池中负极反应为:2NH3-6e-+6OH-═N2+6H2O,正极反应为:O2+4e-+2H2O=4OH-,则电池总反应为:4NH3+3O2═2N2+6H2O,故A正确;
B.a极通入燃料为负极,负极上是燃料氨发生失电子的氧化反应,负极反应为:2NH3-6e-+6OH-═N2+6H2O,故B错误;
C.b极通入氧气为正极,正极上氧气得电子生成氢氧根离子,正极反应为:O2+4e-+2H2O=4OH-,故C错误;
D.溶液中阴离子向负极移动,则OH-迁移至a极,故D错误.
故选A.
点评 本题考查学生燃料电池的工作原理知识,注意知识的迁移应用是解题的关键,难度中等,明确原电池原理以及正负极的判断、电极方程式的书写是解题的关键.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 由溴丙烷水解制取丙醇;由丙烯与水反应制取丙醇 | |
| B. | 由乙酸和乙醇制取乙酸乙酯;由苯甲酸乙酯制取苯甲酸和乙醇 | |
| C. | 由氯代环己烷制取环己烯;由丙烯制取1,2-二溴丙烷 | |
| D. | 由甲苯制取对硝基甲苯;由甲苯制取苯甲酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 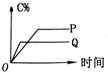 | B. | 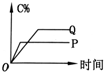 | C. | 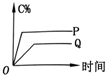 | D. | 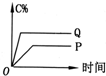 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
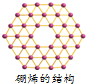
| A. | 是一种新型化合物 | B. | 与金刚石结构相似 | ||
| C. | 与${\;}_{5}^{10}$B互为同素异形体 | D. | 由共价键构成的单质 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 验证镁、铝金属性强弱:分别在MgCl2和AlCl3溶液中滴加氨水直至过量,观察现象 | |
| B. | 检验淀粉水解是否生成葡萄糖:取少量水解液于试管中,直接加入新制的银氨溶液,水浴加热,观察现象 | |
| C. | 探究NaCl是否属于离子化合物:将两个电极插入熔融的NaCl中,进行导电性试验 | |
| D. | 提纯含有少量乙酸的乙酸乙酯:向含有少量乙酸的乙酸乙酯中加入过量NaOH溶液,振荡后静置分液,并除去有机相中的水 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 单质铝不能与烧碱溶液反应 | |
| B. | 丙烷中三个碳原子处于同一直线上 | |
| C. | 丙烷燃烧为放热反应,故C3H8具有的总能量大于CO2和H2O所具有的总能量 | |
| D. | 丙烷完全燃烧的产物对环境无污染,故丙烷为环保型燃料 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 体系总压强不再随时间而改变 | B. | 体系总质量不再随时间而改变 | ||
| C. | NO(g)和 NO2(g)的生成速率相同 | D. | SO3 (g)和 NO(g)的浓度比为 1:1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com