
氧化还原反应综合应用:氧化还原反应滴定
(1)配平氧化还原反应方程式:
C2O42-+ MnO4-+ H+= CO2↑+ Mn2++ H2O
(2)称取6.0 g含H2C2O4·2H2O、KHC2O4和K2SO4的试样,加水溶解,配成250 mL溶液。量取两份此溶液各25 mL,分别置于两个锥形瓶中。
①第一份溶液中加入酚酞试液,滴加0.25 mol·L-1 NaOH溶液至20 mL时,溶液由无色变为浅红色。该溶液被中和的H+的总物质的量为 mol。
②第二份溶液中滴加0.10 mol·L-1的酸性高锰酸钾溶液。
A.KMnO4溶液在滴定过程中作 (填“氧化剂”或“还原剂”),该滴定过程 (填“需要”或“不需要”)另加指示剂。滴至16 mL时反应完全,此时溶液颜色由 变为 。
B.若在接近终点时,用少量蒸馏水将锥形瓶冲洗一下,再继续滴定至终点,则所测结果 (填“偏大”、“偏小”或“无影响”)。
C.若在达到滴定终点时俯视读数,则所得结果 (填“偏大”、“偏小”或“无影响”)。
③原试样中H2C2O4·2H2O的质量分数为 ,KHC2O4的质量分数为 。
(1)5 2 16 10 2 8
(2)①0.005 ②A.氧化剂 不需要 无色 浅紫红色
B.无影响 C.偏小 ③21% 64%
【解析】(1)C:+3―→+4,改变量(4-3)×2=2,Mn:+7―→+2,改变量(7-2)×1=5,根据化合价升降总数相等,所以在C2O42-前配5,MnO4-前配2,根据C和Mn原子守恒,分别在CO2和Mn2+前配10和2,再由电荷守恒在H+前配16,最后根据离子方程式两边的H原子个数相等在水前面配8,经检验离子方程式的氧原子个数相等。
(2)①由H++OH-=H2O知,n(H+)=n(OH-)=0.25 mol·L-1×0.02 L=0.005 mol。②原溶液无色,而KMnO4为紫红色,所以当溶液中的H2C2O4和KHC2O4反应完全时,溶液呈浅紫红色。由得失电子守恒得,n(还)×2=0.10 mol·L-1×0.016 L×5,n(还)=0.004 mol。③设6.0 g试样中H2C2O4·2H2O、KHC2O4的物质的量分别为n(H2C2O4·2H2O)、n(KHC2O4),由①得:2n(H2C2O4·2H2O)+n(KHC2O4)=0.05 mol,由②得:n(H2C2O4·2H2O)+n(KHC2O4)=0.04 mol,解上述两个方程式得:n(H2C2O4·2H2O)=0.01 mol,n(KHC2O4)=0.03 mol,H2C2O4·2H2O的质量分数为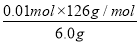 ×100%=21%,KHC2O4的质量分数为
×100%=21%,KHC2O4的质量分数为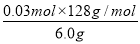 ×100%=64%。
×100%=64%。


科目:高中化学 来源:2014年高考化学一轮复习课后规范训练2-2练习卷(解析版) 题型:填空题
某溶液中可能含有OH-、CO32—、AlO2—、SiO32—、SO42—、K+、Na+、Fe3+、Mg2+、Al3+等离子,当向溶液中逐滴加入一定物质的量浓度的盐酸时,生成沉淀的物质的量与加入盐酸体积的关系如图所示[已知:AlO2—+HCO3—+H2O=Al(OH)3↓+CO32—]。回答下列问题:
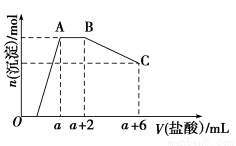
(1)原混合溶液中一定含有的离子是________;
(2)AB段反应的离子方程式是__________________________;
(3)AB段和盐酸反应的离子与BC段和盐酸反应的物质的物质的量之比为______________。
查看答案和解析>>
科目:高中化学 来源:2014年高考化学一轮复习课后规范训练1-3练习卷(解析版) 题型:选择题
对1 mol·L-1的BaCl2溶液的有关叙述中,正确的是( )
A.该溶液中Cl-浓度为2 mol·L-1
B.该溶液中Ba2+的物质的量是1 mol
C.可使用250 mL容量瓶分两次完成490 mL该浓度的BaCl2溶液的配制
D.将208 g BaCl2固体溶解在1 L水中,形成的溶液的浓度为1 mol·L-1
查看答案和解析>>
科目:高中化学 来源:2014年高考化学一轮复习课后规范训练1-1练习卷(解析版) 题型:填空题
铁在冷的浓硫酸中能发生钝化。某兴趣小组的同学发现将一定量的铁与浓硫酸加热时,观察到铁完全溶解,并产生大量气体。实验室现有下列试剂:0.01 mol/L酸性KMnO4溶液、0.1 mol/L KI溶液、3%H2O2溶液、淀粉溶液、蒸馏水。请你协助他们探究所得溶液和气体的成分。
【提出猜想】
Ⅰ.所得溶液中的金属离子可能含有Fe2+和Fe3+中的一种或两种;
Ⅱ.所得气体中可能含有________中的一种或两种。
| 实验操作 | 预期现象 | 结论 |
验证猜想Ⅰ | 步骤①:取少量0.01 mol/L酸性KMnO4溶液,滴入所得溶液 |
|
|
步骤②:________ |
| 含有Fe3 | |
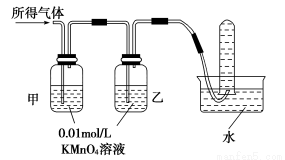
验证猜想Ⅱ | 将所得气体通入如下装置 |
| 含有两种气体 |
【实验探究】
【问题讨论】
有同学提出,若另外选用KSCN溶液,则仅利用KSCN和H2O2两种溶液即可完成猜想Ⅰ的所有探究,判断该方法是否正确并进行评价:_____________________________
查看答案和解析>>
科目:高中化学 来源:2014年高考化学一轮复习课后规范训练1-1练习卷(解析版) 题型:选择题
下列有关除杂的叙述正确的是( )
A.用加入过量氨水并过滤的方法除去NaCl溶液中混有的AlCl3
B.除去乙酸乙酯中少量的乙酸:用饱和碳酸钠溶液洗涤后,分液
C.除去CO2中少量的HCl:气体通过盛有NaOH溶液的洗气瓶
D.除去FeCl3溶液中少量的CuCl2:用足量铁粉,过滤
查看答案和解析>>
科目:高中化学 来源:2014年高考化学一轮复习2-3-2氧化还原反应方程式配平及计算练习卷(解析版) 题型:填空题
近年来地质、环境灾难频频发生,为防止在大灾之后疫病流行,灾区需要大量的各种消毒剂、漂白剂等。
(1)二氧化氯是目前国际上公认的第四代高效、无毒的广谱消毒剂,它可由KClO3与SO2在H2SO4作用下反应制得。请写出反应的离子方程式: 。
(2)过碳酸钠是一种新型固态漂白剂,化学式可表示为Na2CO3·3H2O2,它具有Na2CO3和H2O2的双重性质。过碳酸钠与下列物质均会发生化学反应而失效,其中过碳酸钠只发生了氧化反应的是 。
A.MnO2 B.KMnO4溶液 C.稀盐酸 D.Na2SO3溶液
(3)漂白剂亚氯酸钠(NaClO2)在常温下黑暗处可保存一年,HClO2不稳定可分解,反应的离子方程式为HClO2―→ClO2↑+H++Cl-+H2O(未配平)。当1 mol HClO2分解时,转移的电子数是 。
查看答案和解析>>
科目:高中化学 来源:2014年高考化学一轮复习2-3-2氧化还原反应方程式配平及计算练习卷(解析版) 题型:选择题
O3具有强氧化性,将O3通入KI溶液中发生反应:O3+I-+H+―→I2+O2+H2O(未配平),下列说法正确的是 ( )。
A.配平后的离子方程式为2O3+2I-+4H+=I2+2O2+2H2O
B.每生成1 mol I2转移电子2 mol
C.O2是还原产物之一
D.该反应能说明O2的氧化性大于I2的
查看答案和解析>>
科目:高中化学 来源:2014年高考化学 题型十四 定量计算型专题练习卷(解析版) 题型:选择题
向x mL 2.0 mol·L-1的盐酸中投入a g镁铝合金,金属完全溶解,再加入y mL 1.0 mol·L-1的NaOH溶液沉淀达到最大值,且质量为(a+1.7) g,则下列说法不正确的是 ( )
A.x=2y
B.镁铝合金与盐酸反应时转移电子的数目为0.1NA
C.镁铝合金与盐酸反应产生H2的体积在常温常压下大于1.12 L
D.a的取值范围为0.9 g<a<1.2 g
查看答案和解析>>
科目:高中化学 来源:2014年高考化学 题型十三 表格实验型专题练习卷(解析版) 题型:选择题
下列实验操作与预期实验目的或所得实验结论一致的是( )
选项实验操作和现象预期实验目的或结论
A用洁净的铂丝蘸取某食盐试样,在酒精灯火焰上灼烧,火焰显黄色]说明该食盐不是加碘盐
B银氨溶液中滴入少量组成为C2H4O2的液态有机物,水浴微热,有银镜出现可确定该有机物一定是甲酸甲酯
C向两支盛有KI3的溶液的试管中,分别滴加淀粉溶液和AgNO3溶液,前者溶液变蓝,后者有黄色沉淀 KI3溶液中存在平衡:I3- I2+I-
I2+I-
D室温下向CuCl2和少量FeCl3的混合溶液中,加入铜屑,充分搅拌,过滤,得蓝绿色溶液 除去杂质FeCl3得纯净CuCl2溶液
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com