
常温下,在溶液中可发生以下反应:
①16H+ +10Z-+2XO4-=== 2X2+ +5Z2 +8H2O,
②2M2++R2 ===2M3++ 2R-,
③2 R-+Z2 ===R2 +2Z-,由此判断下列说法不正确的是( )
A.常温下反应2M2+ + Z2 ===2M3+ + 2Z-可以自发进行
B.Z元素在反应①中被氧化,在③中被还原
C.氧化性强弱顺序为: XO4- < Z2 < R2 < M3+
D.还原性强弱顺序为: X2+ < Z- < R- < M2+
C
【解析】
试题分析:对于一个氧化还原反应来说,左边氧化剂的氧化性大于右边氧化产物的氧化性,左边还原剂的还原性大于右边还原产物的还原性,所以从①16H+ +10Z-+2XO4-=== 2X2+ +5Z2 +8H2O,可以看出XO4->X2+,C错误,为本题的正确答案,A正确,常温下反应2M2+ + Z2 === 2M3+ + 2Z-可以自发进行,因为还原性Z- < M2+;B正确,Z元素在反应①中的化学价升高,被氧化,在在③中的化学价降低,被还原;D正确,还原性强弱顺序为: X2+ < Z- < R- < M2+。
考点:氧化还原反应
点评:本题考查了氧化还原反应,该考点是高考考查的重点,本题要掌握对于一个氧化还原反应来说,左边氧化剂的氧化性大于右边氧化产物的氧化性,左边还原剂的还原性大于右边还原产物的还原性,该题难度适中。


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 下图所示(反应条件均已略去).
下图所示(反应条件均已略去).
| ||
| △ |
| ||
| △ |
查看答案和解析>>
科目:高中化学 来源:物理教研室 题型:013
已知常温下在溶液中可发生发下两个离子反应:
 .
.
由此可确定 、
、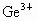 、
、 三种离子的还原性由强到弱的顺序是
三种离子的还原性由强到弱的顺序是
[ ]
A. 、
、 、
、 B.
B. 、
、 、
、
C. 、
、 、
、 D.
D. 、
、 、
、
查看答案和解析>>
科目:高中化学 来源: 题型:013
已知常温下在溶液中可发生发下两个离子反应:
 .
.
由此可确定 、
、 、
、 三种离子的还原性由强到弱的顺序是
三种离子的还原性由强到弱的顺序是
[ ]
A. 、
、 、
、 B.
B. 、
、 、
、
C. 、
、 、
、 D.
D. 、
、 、
、
查看答案和解析>>
科目:高中化学 来源:2010-2011学年河南省许昌市三校高三上学期期末考试(理综)化学部分 题型:填空题
A、B、C、D是短周期元素形成的四种气体单质。E、F均为气体,且F为红棕色。有关的转化关系如下图所示(反应条件均已略去)。

请回答下列问题:
(1)D的化学式为 ;
(2)反应③的离子方程式为 。
(3)Y和E在一定条件下可反应生成B和Z,这是一个具有实际意义的反应,可消除E对环境的污染,该反应的化学方程式为 。
(4)0.1mol/L的X溶液和0.1mol/L的Y溶液等体积混合,溶液呈________性;(填“酸”、“碱”或“中”)该溶液中各离子浓度大小关系为:_______________________
(5)常温下0.1mol/L的Y溶液中c(H+)/c(OH-)=110-8,下列叙述正确的是( )
A.该溶液的pH=11;
B.该溶液中的溶质电离出的阳离子浓度0.1mol/L
C.该溶液中水电离出的c(H+)与c(OH-)乘积为110-22
D. pH=3的盐酸溶液V1 L与该0.1mol/L的Y溶液V2 L混合,若混合溶液pH=7,则:V1>V2
E.将pH=11的Y溶液加水稀释100倍后,pH值为9;
(6)化合物E在一定条件下于一定体积的容器中可发生身氧化还原反应,测得容器内气体的压强略小于原来的2/3,请写出该反应的化学方程式
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com