
| A. | 常温下,0.5mo1•L-1Fe2(SO4)3溶液中含Fe3+数目为1NA | |
| B. | 标准状况下,22.4L苯中含C-H数目为6NA | |
| C. | 常温常压下,16gO2和O3混合气体中,含氧原子的总数为1NA | |
| D. | 5.6gFe与足量稀盐酸反应,转移电子数为0.3NA |
分析 A.缺少溶液体积,无法计算溶液中铁离子的数目;
B.标准状况下,苯的状态不是气态;
C.氧气和臭氧分子中都只含有氧元素,根据n=$\frac{m}{M}$计算出混合物中含有氧原子的物质的量;
D.铁与稀盐酸反应生成的是氯化亚铁.
解答 解:A.没有告诉0.5mo1•L-1Fe2(SO4)3溶液的体积,无法计算溶液中含有的铁离子数目,故A错误;
B.标准状况下苯不是气体,不能使用标准状况下的气体摩尔体积计算,故B错误;
C.16gO2和O3混合气体中含有16g氧元素,含有氧原子的物质的量为:$\frac{16g}{16g/mol}$=1mol,含氧原子的总数为NA,故C正确;
D.5.6g铁的物质的量为:$\frac{5.6g}{56g/mol}$=0.1mol,0.1molFe与足量稀盐酸反应生成0.1mol氯化亚铁,转移了0.2mol电子,转移电子数为0.2NA,故D错误;
故选C.
点评 本题考查了物质的量的计算与判断,题目难度中等,注意掌握物质的量与阿伏伽德罗常数、摩尔质量、气体摩尔体积的关系,明确标准状况下气体摩尔体积的使用条件,试题培养了学生的分析能力及化学计算能力.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:推断题
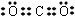 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 正极质量不变 | B. | 电流通过导线由铜片流向银片 | ||
| C. | 烧杯中Ag+浓度逐渐减小 | D. | 电池工作时,铜片失电子,被还原 |
查看答案和解析>>
科目:高中化学 来源:2016-2017学年江西省高一上第一次月考化学卷(解析版) 题型:推断题
现有三种可溶物质A、B、C,其中A、B是盐,一种是酸式盐,一种是正盐,C是碱,它们溶于水后电离产生的所用离子如下表所示:
阳离子 |
|
阴离子 |
|
请根据下列叙述回答问题:
(1)C的化学式为_________________。
(2)A溶液与B溶液反应可生成气体X,则X的化学式为_______________________, 该反应的离子方程式为___________________.
该反应的离子方程式为___________________.
(3)A、B溶液与C溶液反应可分别生成白色沉淀D和E,其中D可溶于稀硝酸.
①B的化学式为____________,鉴别溶液中B的阴离子的方法是____________________.
②D溶于稀硝酸的离子方程式为________________________.
查看答案和解析>>
科目:高中化学 来源:2016-2017学年江西省高一上第一次月考化学卷(解析版) 题型:选择题
下列反应的离子方程式书写正确的是
A.铜和醋酸反应:Cu+2CH3COOH 2CH3COO-+Cu2++H2↑
2CH3COO-+Cu2++H2↑
B.氧化铁与稀盐酸反应:Fe2O3+6H+ 2Fe3++3H2O
2Fe3++3H2O
C.锌与硝酸银溶液反应:Zn+Ag+ Zn2++Ag
Zn2++Ag
D.稀硝酸和石灰乳反应:H++OH- H2O
H2O
查看答案和解析>>
科目:高中化学 来源:2016-2017学年安徽省高一上第一次月考化学卷(解析版) 题型:实验题
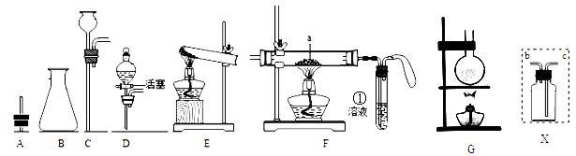
(1)用上图仪器组装成气体发生装置:制取O2可选的装置是______________。
(2)若用装置X收集制取的O2,瓶中装满水,氧气应从_____________端通入。
(3)若用F装置进行CO还原CuO的实验,实验室制取CO的方法可采取甲酸脱水法(HCOOH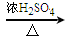 CO↑+H2O),用纯净的CO完成该实验。
CO↑+H2O),用纯净的CO完成该实验。
I.除F、X外还需要的装置有______________,X中应加入的试剂是_________。
II.实验时①处选择的溶液可以为_______,其作用是_____________;F装置中气球的作用是____________________。
查看答案和解析>>
科目:高中化学 来源:2017届江苏省高三上第一次测试化学试卷(解析版) 题型:实验题
硫化钠主要用于皮革、毛纺、高档纸张、染料等行业。生产硫化钠大多采用无水芒硝(Na2SO4)—炭粉还原法,其流程示意图如下:
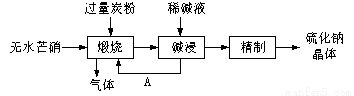
(1)上述流程中“碱浸”后,物质A必须经过 (填写操作名称)处理后,方可“煅烧”;若煅烧所得气体为等物质的量的CO和CO2,写出煅烧时发生的总的化学反应方程式为 。
(2)上述流程中采用稀碱液比用热水更好,理由是稀碱液能 Na2S水解(选促进或抑制)
(3)取硫化钠晶体(含少量NaOH)加入到硫酸铜溶液中,充分搅拌。若反应后测得溶液的pH=4,则此时溶液中c( S2-)= mol·L-1。(已知:常温时CuS、Cu(OH)2的Ksp分别为8.8×10-36、2.2×10-20)
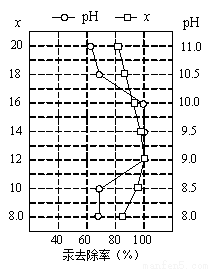
(4)①皮革工业废水中的汞常用硫化钠除去,汞的去除率与溶液的pH和x(x代表硫化钠的实际用量与理论用量的比值)有关(如右图所示)。为使除汞效果最佳,应控制的条件是x控制 、pH控制 。
②某毛纺厂废水中含0.001 mol·L-1的硫化钠,与纸张漂白后的废水(含0.002 mol·L-1 NaClO)按1:2的体积比混合,能同时较好处理两种废水,处理后的废水中所含的主要阴离子有 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com