
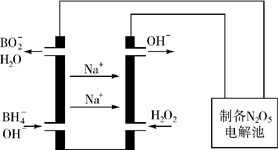
 氮的重要化合物如氨、肼(N2H4)、NO、NO2、HNO3、硝酸盐等,在生产、生活中具有重要作用.
氮的重要化合物如氨、肼(N2H4)、NO、NO2、HNO3、硝酸盐等,在生产、生活中具有重要作用.| 0.01mol•L-1的溶液 | X | Y | Z | W |
| pH | 12 | 2 | 8.5 | 4.5 |
分析 (1)H2O(l)=H2O(g)△H1=44.0kJ•mol-1 (i)
N2(g)+O2(g)=2NO(g)△H2=229.3kJ•mol-1 (ii)
4NH3(g)+5O2(g)=4NO(g)+6H2O(g)△H3=-906.5kJ•mol-1 (iii)
由盖斯定律可知(iii)-(ii)×5-(i)×6得:4NH3(g)+6NO(g)=5N2(g)+6H2O(l);
(2)部分电离的电解质是弱电解质,如果亚硝酸部分电离则亚硝酸是弱电解质,可以根据酸溶液或钠盐溶液的pH判断;
(3)在25℃下,将amol/L的氨水与b mol/LH2SO4溶液等体积混合,充分反应后有:2c(SO42-)=c(NH4+),反应平衡时溶液呈中性,c(H+)=c(OH-),根据物料守恒得n(NH3.H2O)=(0.5a-b)mol/L,根据电荷守恒得c(H+)=c(OH-)=10-7mol/L,溶液呈中性,NH3•H2O的电离常数Kb=$\frac{c(O{H}^{-})c(N{{H}_{4}}^{+})}{c(N{H}_{3}•{H}_{2O})}$;
(4)依据题意,反应物为Co2+与肼(N2H4)、碱性条件下存在OH-,生成物为:钴单质,据此得出Co的化合价降低,故N的化合价升高,只能为0价,即氮气,依据氧化还原反应得失电子守恒回答即可;
(5)X、Y、Z各1mol•L-1同时溶于水中制得混合溶液,溶液中的溶质为等物质的量浓度的硝酸钠和亚硝酸钠,亚硝酸钠能水解而使溶液呈碱性,则c(OH-)>c(H+),钠离子和硝酸根离子都不水解,但盐类水解较微弱,所以离子浓度大小关系是c(Na+)>c(NO3-)>c(NO2-)>c(OH-)>c(H+).
解答 解:(1)H2O(l)=H2O(g)△H1=44.0kJ•mol-1 (i)
N2(g)+O2(g)=2NO(g)△H2=229.3kJ•mol-1 (ii)
4NH3(g)+5O2(g)=4NO(g)+6H2O(g)△H3=-906.5kJ•mol-1 (iii)
(iii)-(ii)×5-(i)×6得:4NH3(g)+6NO(g)=5N2(g)+6H2O(l),故△H4=-906.5-(229.3×5)-(44×6)=-2317.0kJ•mol-1,
故答案为:-2317.0;
(2)A、亚硝酸钠溶液的pH>7,说明亚硝酸钠是强碱弱酸盐,其溶液呈碱性,所以能证明亚硝酸是弱酸,故A正确;
B、亚硝酸能与氢氧化钠发生中和反应只能说明亚硝酸具有酸性,不能说明亚硝酸的电离程度,所以不能证明亚硝酸是弱酸,故B错误;
C、用亚硝酸钠溶液作导电实验,灯泡很暗,不能说明亚硝酸的电离程度,所以不能证明亚硝酸是弱酸,故C错误;
D、常温下,将pH=3的亚硝酸溶液稀释10倍,pH<4,说明稀释亚硝酸时,其氢离子物质的量增大,存在电离平衡,故D正确;
故答案为:AD;
(3)在25℃下,将amol/L的氨水与b mol/LH2SO4溶液等体积混合,充分反应后有:2c(SO42-)=c(NH4+)=bmol/L,反应平衡时溶液呈中性,c(H+)=c(OH-),根据物料守恒得n(NH3.H2O)=(0.5a-b)mol/L,根据电荷守恒得c(H+)=c(OH-)=10-7mol/L,溶液呈中性,NH3•H2O的电离常数Kb=$\frac{c(O{H}^{-})c(N{{H}_{4}}^{+})}{c(N{H}_{3}•{H}_{2O})}$=$\frac{1{0}^{-7}×b}{0.5a-b}$=$\frac{2b}{a-2b}$×10-7,
故答案为:$\frac{2b}{a-2b}$×10-7;
(4)依据题意,反应物为Co2+与肼(N2H4)、碱性条件下存在OH-,生成物为:钴单质,据此得出Co的化合价降低,故N的化合价升高,只能为0价,即氮气,据此得出还有水生成,氧化还原反应中存在得失电子守恒以及元素守恒,故此反应的离子反应方程式为:2Co2++N2H4+4OH-=2Co↓+N2↑+4H2O,
故答案为:2Co2++N2H4+4OH-=2Co↓+N2↑+4H2O;
(5)X、Y、Z各1mol•L-1同时溶于水中制得混合溶液,溶液中的溶质为等物质的量浓度的硝酸钠和亚硝酸钠,亚硝酸钠能水解而使溶液呈碱性,则c(OH-)>c(H+),钠离子和硝酸根离子都不水解,但盐类水解较微弱,所以离子浓度大小关系是c(Na+)>c(NO3-)>c(NO2-)>c(OH-)>c(H+),
故答案为:c(Na+)>c(NO3-)>c(NO2-)>c(OH-)>c(H+).
点评 本题考查了热化学方程式和盖斯定律的计算应用、化学平衡的移动、弱电解质的电离平衡判断、盐类水解以及离子浓度大小比较,考查范围广,难度较大.


 发散思维新课堂系列答案
发散思维新课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | 降低温度可以加快反应速率 | |
| B. | 达到化学反应限度时,生成2mol NH3 | |
| C. | 1mol N2 和3mol H2的总能量低于2mol NH3的总能量 | |
| D. | 向容器中再加入N2可加快正反应速率 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2 mol SO2和足量O2反应,必定生成2 mol SO3 | |
| B. | 平衡时,SO2消耗速率必定等于O2生成速率的两倍 | |
| C. | 其他条件不变,增大压强,平衡必定向正反应方向移动 | |
| D. | 平衡时,SO2浓度必定等于O2浓度的两倍 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 实验步骤 | 预期现象及结论 |
| 步骤1:取适量“氢铵”配制成溶液,取1~2ml试液于一支洁净的试管中,加足量BaCl2溶液,充分振荡. | ①若出现白色沉淀,证明氢铵中含有(NH4)2CO3; ②若没有明显现象可能含有NH4HCO3 |
| 步骤2:静置,取上层清液少许于另一试管中, 继续滴加滴加适量Ba(OH)2溶液,振荡观察现象. | 若出现白色沉淀,证明氢铵中含有NH4HCO3结合步骤1②,则假设1成立; 结合步骤1①,则假设3成立; 仅在步骤1中产生白色沉淀,则假设2成立;. |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 若C(s)+O2(g)=CO2(g)△H1,CO2(g)+C(s)=2CO(g)△H2,2CO(g)+O2(g)=2CO2(g)△H3,则反应热的关系:△H1=△H2+△H3 | |
| B. | 若2H2(g)+O2(g)=2H2O(1)△H4,H2(g)+$\frac{1}{2}$O2(g)=H2O(1)△H5,则反应热的关系:△H4=△H5 | |
| C. | 若2SO2(g)+O2(g)=2SO3(g)△H<O,则物质的稳定性:SO2>SO3 | |
| D. | 若断裂1molH2(g)中的H-H键、断裂1 molO2(g)中的共价键分别需要吸收436 kJ、498 kJ的能量,生成H2O(g)中的1 mol H-O键能放出463kJ的能量,则2H2(g)+O2(g)=2H2O(g)△H=-482kJ.mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 大量生产、使用能过滤PM2.5的口罩 | |
| B. | 用石灰对煤燃烧后形成的烟气进行脱硫处理 | |
| C. | 开发利用太阳能、氢能、风能等清洁能源 | |
| D. | 研究廉价、高效的催化剂,以降低汽车尾气中有害物质的含量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 汽油、柴油和植物油都是碳氢化合物 | |
| B. | 葡萄糖和银氨溶液发生银镜反应可用作制镜子 | |
| C. | 往花生油中加入稀硫酸能发生皂化反应 | |
| D. | 鸡蛋清中加入胆矾可以使蛋白质发生盐析 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com